
����Ŀ������[KAl��SO4��212H2O]����ֽ����ˮ�ȷ���Ӧ�ù㷺���Դ������ķϾ���������мΪԭ�ϣ���Ҫ�ɷ�ΪAl������������Fe��Mg���ʣ��Ʊ������Ĺ�����ͼ��ʾ�� 
��1������1�����2��ʵ�����ƾ�Ϊ ��
��2��ԭ���ܽ�����з�Ӧ�Ļ�ѧ����ʽ�� ��
��3������D�����ᷴӦ�����ӷ���ʽ�� ��
��4����ҺC�к��е���Ҫ������ ��
��5��Ϊ֤������B�к�������ijͬѧ������ʵ�飺ȡ��������B������ϡ����ʹ���ܽ⣬�۲쵽����ɫ�������ɣ�����Һ�м��� �� ������죬֤������B�к�������
���𰸡�
��1������
��2��2Al+2NaOH+2H2O�T2NaAlO2+3H2��
��3��NaHCO3
��4��NaHCO3
��5��KSCN��Һ����ˮ
���������⣺�Ͼ���������м����Ҫ�ɷ�ΪAl������������Fe��Mg���ʣ�����������������Һ��Ӧ����ƫ�����ƺ����������˺�õ���ҺAΪƫ��������Һ������BΪFe��Mg����ҺA��ͨ�����������̼��������������������̼�����ƣ�ͨ�����˵õ�̼��������Һ����ҺC������������������D��������D[Al��OH��3]��ϡ���ᷴӦ������������������������ؼ��ȿ��Եõ�����[KAl��SO4��212H2O]����1������1��������Ƿ������������Һ����������Ϊ���ˣ�
���Դ��ǣ����ˣ���2��ԭ���ܽ����Ϊ��������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O�T2NaAlO2+3H2����
���Դ��ǣ�2Al+2NaOH+2H2O�T2NaAlO2+3H2������3������DΪAl��OH��3��Al��OH��3�����ᷴӦ������������ˮ����Ӧ�����ӷ���ʽ�ǣ�Al��OH��3+3H+�TAl3++3H2O��
���Դ��ǣ�Al��OH��3+3H+�TAl3++3H2O����4�����ݷ�����֪����ҺCΪNaHCO3��Һ��
���Դ��ǣ�NaHCO3����5��ȡ��������B������ϡ����ʹ���ܽ⣬�۲쵽����ɫ�������ɣ�Fe��ϡ���ᷴӦ������������������Һ��KSCN��Һ��ɫ���ټ�����ˮ��Һ������죬֤����Ӧ����Һ�к����������ӣ������B�к�������
���Դ��ǣ�KSCN��Һ����ˮ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ������λ����ͼ��ʾ����֪Wԭ�ӵ��������������ڲ��������3 ��������˵����ȷ���ǣ� �� 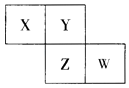
A.�������Ӧˮ��������W��Zǿ
B.Y������Z���⻯��ˮ��Һ��Ӧ���г�������
C.X����������ǿ��Y����
D.�����ӵİ뾶��Z��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������С����ҽԺ����Ѫ�����鱨�浥�IJ�������.С��Ӧע�ⲹ�����Ԫ����( )
��� | ��Ŀ | ��� | ������Χ | ��λ |
1 | ��ϸ������ | 2.3 | 3.5��5 | ��1012/L |
2 | Ѫ�쵰�� | 75 | 110��150 | g/L |
3 | ѪС����� | 205.0 | 100��300 | ��109/L |
A.��
B.п
C.��
D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܣ�Co��������Ni����ͬ��Ԫ�أ����ǽϻ��õĽ��������ǵĻ������ڹ�ҵ������Ҫ��Ӧ�ã�
��1�������ܣ�CoCO����һ��������ˮ��dz�ۺ�ɫ��ĩ��ͨ������������Һ�Ͳ������Һ��Ӧ�Ƶã�д���÷�Ӧ�����ӷ���ʽ��
��2���ֽ���0.5mol FeCl3����Һ�ͺ�0.5mol KSCN����Һ��ϣ���Ϻ���Һ���Ϊ1L����֪��Һ����ƽ�⣺Fe3++SCN��Fe��SCN��2+�������������̣���ƽ��Ũ��c[Fe��SCN��2+]���¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ��H0����������������¶�ΪT1ʱ����Ӧ��5����ʱ�ﵽƽ�⣬ƽ��ʱc[Fe��SCN��2+]=0.45mol/L����ﵽƽ��ʱ��ƽ����Ӧ����
v��SCN����=molL��1S��1 �� ���¶��µ�Fe3+��ƽ��ת����Ϊ �� ���¶��·�Ӧ��ƽ�ⳣ��Ϊ �� 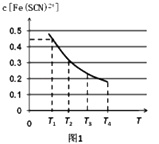
��3����֪ij��Һ�У�Co2+��Ni2+��Ũ�ȷֱ�Ϊ0.60mol/L��1.2mol/L��ȡһ�����ĸ���Һ�������еμ�NaOH��Һ����Co��OH��2��ʼ����ʱ����Һ�� ![]() ��ֵ���� �� ��ȡ��λ��Ч���֣�
��ֵ���� �� ��ȡ��λ��Ч���֣�
����֪Ksp[Co��OH��2]=6.0��10��15 �� Ksp[Ni��OH��2]=2.0��10��15��
��4����ҵ�ϻ�����ͨ�����ŨNaOH��Һ�Ʊ�Na2FeO4 �� �乤��ԭ����ͼ2��ʾ���������ĵ缫��ӦʽΪ �� 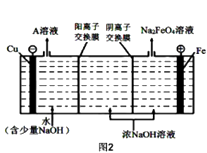
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ����������һ�ֳ�������ԭ�ϣ���ƫ���������ϩ����C5H10��Ϊԭ�Ϻϳ�ij����Ԫ������C7H10O4���ĺϳ�·�����£� ![]()
��֪��һ��̼ԭ��������2����OH���ȶ���������ˮ��� 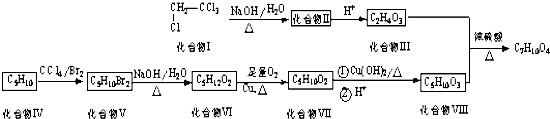
��1��������II��������������Ʒ�Ӧ�Ĺ���������Ϊ ��
��2��������IV�ϳɻ�����V�ķ�Ӧ����Ϊ �� ������V�ϳɻ�����VI��Ӧ����Ϊ ��
��3��д���ɻ�����VI�ϳɻ�����VII�ķ�Ӧ����ʽ ��
��4���л���R�ǻ�����IV��ͬ���칹�壬R��ʹ��ˮ��ɫ������˴Ź�����������4��壬�л���R�Ľṹ��ʽΪ �� ����Ԫ������C7H10O4���Ľṹ��ʽΪ
��5�������Ϻϳ�·�ߣ�������л���Cl2CH2��CH2Cl2���Ҷ���Ϊԭ�Ϻϳɾ��Ҷ����Ҷ������ĺϳ�·�ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z���ֶ�����Ԫ�ص�ԭ��������X��W��Z��Y��Wԭ�ӵ������û��p���ӣ�Xԭ�Ӻ���s��������p������֮��Ϊ1��1��Yԭ�������s������֮��Ϊ1��1��Zԭ�ӵ�p��������Yԭ�ӵĶ�2����
��1������Ԫ��ԭ�Ӱ뾶�Ӵ�С��˳��Ϊ����Ԫ�ط��ű�ʾ����
��2�����á�����������գ�
��һ������ | �縺�� | �⻯��е� | ����������Ӧˮ����ļ��� |
WX | ZY | YZ | WX |
��3��д��XԪ�صĵ�����Z��Y���γɵĻ����ﷴӦ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2һ������ϩ����ͼ���ֽṹ�� 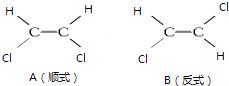
�Իش��������⣺
��1��A��B������������ѧ�����������ͬ����ͬ������ͬ�������Ӽ�����
��2��A��B���ַ�����CCl4���ܽ�Ƚϴ������
��3����A��B����Br2��CCl4��Һ�У��ɵ�����C����C�Ľṹ��ʽΪ �� C��������С����ޡ��������칹�壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��X��Y��Zԭ������֮��Ϊ37��X��Y��ͬһ���ڣ�X����Z��������ͬ�ĺ�����Ӳ�ṹ�������Ʋⲻ��ȷ����
A. ͬ����Ԫ����X�Ľ�������ǿ B. ͬ��Ԫ����Z���⻯���ȶ������
C. ԭ�Ӱ뾶X��Y�����Ӱ뾶X����Z�� D. ͬ����Ԫ����Y����ۺ������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C��ʳ�ζ�����������Ҫ����Ҫ���ʡ�����˵����ȷ����( )��
A.ά����C��ʳ�ζ���ǿ�����
B.ά����C��ʳ�ζ��ǹ�������
C.ά����C���л�ԭ�ԣ��ڿ������ױ�����
D.�����ʵ�����ά����C��ʳ������ˮ��������������ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com