
【题目】下列说法中,正确的是( )
A. 22.4LN2含阿伏加德罗常数个氮分子
B. 在标准状况下,22.4L水的质量约为18g
C. 标准状况下,相同体积的任何气体单质所含的原子数相同
D. 22g二氧化碳与标准状况下11.2LHCl含有相同的分子数
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是:
A. Cl2通往NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2O
B. NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O
C. AlCl3溶液中加入过量稀氨水:Al3++4NH3H2O =AlO2-+4NH4++2H2O
D. Cu溶液于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ. CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。

(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
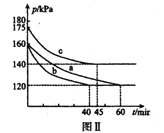
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
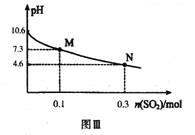
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A. NH3·H2O B. Na2S C. Na2CO3 D. FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中的物质均能发生丁达尔效应的是( )
A. 雾、含灰尘颗粒的空气、有色玻璃 B. 酒、生理盐水、花生油
C. 水晶、金刚石、冰 D. 大理石、高岭石、电石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。则下列说法正确的是( )
A. 物质的量:甲>乙 B. 气体体积:甲>乙
C. 气体摩尔体积:甲>乙 D. 相对分子质量:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长式周期表共有18个纵行,碱金属为第1列,稀有气体元素为第18列。按这种规定下列说法正确的是( )
A.第四周期第9列元素是铁元素
B.只有第二列的元素原子最外层电子排布为ns2
C.第9列中元素中没有非金属元素
D.第10、11列为ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月6日,上海遭遇重度雾霾,空气质量指数达六级重度污染。雾霾是雾和霾的混合物,其中雾是自然天气现象,霾的核心物质是悬浮在空气中的烟、灰尘等物质,其中霾属于悬浊液,雾所属的分散系是( )
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
硫酸
分子式:H2SO4
相对分子质量:98
密度:1.84g/mL
H2SO4的质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为_________。
(2)某学生欲用上述浓硫酸和蒸馏水配制100mL物质的量浓度为0.8 mol·L-1的稀硫酸,该学生需要量取_________mL上述浓硫酸进行配制。
(3)为配制(2)中的稀硫酸,除了量筒、烧杯、胶头滴管外,还缺少的玻璃仪器是_________。
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是_________(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出;
f.未洗涤稀释浓硫酸的烧杯;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com