
【题目】下列说法正确的是
A.饱和氯水中加水稀释,促进氯水中水的电离
B.向氨水中加入氯化铵,由于氯化铵溶液呈酸性,所以溶液pH降低
C.碳酸钠溶液中存在CO32-+H2O![]() HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
D.向氢氧化镁悬浊液中加水稀释,Mg(OH)2沉淀溶解平衡正向移动,但c(Mg2+)降低
【答案】A
【解析】
A、氯气与水反应生成HCl,会抑制水的电离,加水稀释,H+浓度降低,对水的电离抑制减弱,促进氯水中水的电离,A正确;
B、氨水中存在以下平衡NH3·H2O![]() NH4 ++OH-,加入NH4 +平衡向左移动,OH-浓度降低,pH降低,并不是由于氯化铵溶液呈酸性,pH才降低,B错误;
NH4 ++OH-,加入NH4 +平衡向左移动,OH-浓度降低,pH降低,并不是由于氯化铵溶液呈酸性,pH才降低,B错误;
C、CO32-+H2O![]() HCO3-+OH-,通二氧化碳CO2+2OH-=CO32-+H2O,第二步减少了第一步的产物氢氧根,增加了反应物碳酸根,促使第一步反应向正方向(右)移动,C错误;
HCO3-+OH-,通二氧化碳CO2+2OH-=CO32-+H2O,第二步减少了第一步的产物氢氧根,增加了反应物碳酸根,促使第一步反应向正方向(右)移动,C错误;
D、Mg(OH)2沉淀溶解平衡正向移动,Mg2+增加,但由于溶解度不变,仍是饱和溶液,c(Mg2+)不变,D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )

A. 分子中有3个手性碳原子
B. 分子中有3种含氧官能团
C. 该物质既可发生消去反应又可发生加成反应
D. 1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③0.1 mol/L NH4HSO4 ④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O,请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”“碱”或“中”),其原因是_____________(用离子方程式表示)
(2)在溶液④中______离子的浓度为0.1mol/L;NH3·H2O和_____离子的量浓度之和为0.2mol/L。
(3)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_______(填“>”“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)______c(NH4+)
(4)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式________。
②若溶液M由10mL 2mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”)。
(5)已知:在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液。回答下列问题:
①两溶液中,c(H+)·c(OH-)=__________。
②各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液。
③各取5mL上述溶液,分别加热到90℃,pH较小的是__________溶液。
④H2SO4和NH4Cl两溶液中,由水电离出的c(H+)分别为__________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以石油为原料的部分转化流程:
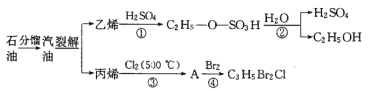
已知:C2H5Br+NaOH![]() C2H5OH+NaBr(水解反应)
C2H5OH+NaBr(水解反应)
(1)反应①的类型是_________,由乙烯制备乙醇的过程中,硫酸起________作用;
(2)已知A的分子式为C3H5Cl,则A的结构简式为___________;
(3)C3H5Br2Cl与NaOH水溶液完全反应生成有机产物X,则1molX与足量的Na单质反应可生成标况下_________L氢气;
(4)写出丙烯通入溴的CCl4溶液中发生反应的化学方程式:______________________。
(5)相对分子质量为72且沸点最低的烷烃的结构简式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如右图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是
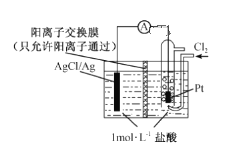
A.正极反应AgCl +e-= Ag+Cl-
B.正极反应Cl2 +2e- +2Ag+=2AgCl
C.放电时右侧盐酸的浓度变大
D.当电路中转移0.01 mol e-时,析出沉淀1.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水资源利用的部分过程。
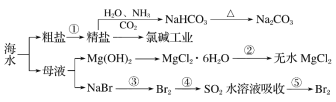
下列有关说法正确的是( )
A.用澄清石灰水可鉴别NaHCO3和Na2CO3
B.第③步和第⑤步均发生了氧化还原反应
C.在第③④⑤步中溴元素均被氧化
D.将MgCl2·6H2O加热蒸发可得无水MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成![]() 气态分子,其立体结构呈三角锥形.
气态分子,其立体结构呈三角锥形.![]() 在气态和液态时,分子结构如图所示,下列关于
在气态和液态时,分子结构如图所示,下列关于![]() 分子的说法中不正确的是
分子的说法中不正确的是![]()
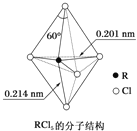
A.分子中5个![]() 键键能不都相同
键键能不都相同
B.键角![]() 有
有![]() 、
、![]() 、
、![]() 几种
几种
C.![]() 受热后会分解生成分子立体结构呈三角锥形的
受热后会分解生成分子立体结构呈三角锥形的![]()
D.每个原子都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
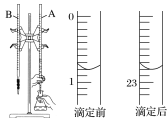
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________,判断c中恰好完全反应所依据的现象是___________。
②写出步骤b的离子方程式_____________________。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566.0kJ/mol
2CO2(g) ΔH=566.0kJ/mol
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5kJ/mol
2NO(g) ΔH=+180.5kJ/mol
③2NO(g)+O2(g)![]() 2NO2(g) ΔH=116.5kJ/mol
2NO2(g) ΔH=116.5kJ/mol
回答下列问题:
(1)CO的燃烧热为___。若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)CO将NO2还原为单质的热化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com