
【题目】某原电池装置如右图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是
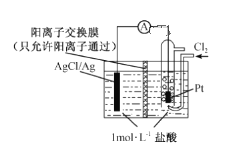
A.正极反应AgCl +e-= Ag+Cl-
B.正极反应Cl2 +2e- +2Ag+=2AgCl
C.放电时右侧盐酸的浓度变大
D.当电路中转移0.01 mol e-时,析出沉淀1.08g
【答案】C
【解析】
A. 正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e═2Cl,故A错误;
B. 正极上氯气得电子生成氯离子,而正极处没有Ag+,其电极反应为:Cl2+2e═2Cl,故B错误;
C. 放电时右侧生成Cl-,左侧的H+通过阳离子交换膜进入右侧,则右侧盐酸的浓度变大,故C正确;
D. 放电时,当电路中转移0.01mole时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成0.01mol氯化银沉淀,0.01mol×143.5g/mol≈1..44g,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
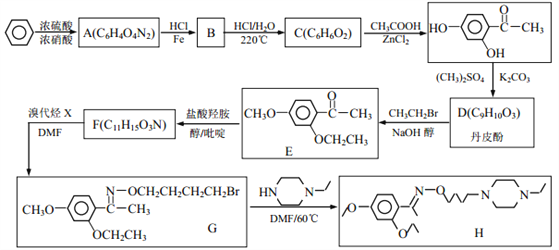
【题目】乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活性,是良好的心脑血管疾病的治疗药物。
已知:①![]()
②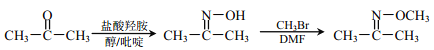
③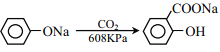
请回答:
(1)E中含有的官能团名称为_________;
(2)丹皮酚的结构简式为_________;
(3)下列说法不正确的是(___)
A.乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3
B.物质B 可能溶于水,且能与盐酸反应生成有机盐
C. D→E 和 G→H 的反应类型均为取代反应
D.物质 C 能使浓溴水褪色,而且 1mol C 消耗 2molBr2
(4)写出 F→G 的化学方程式_________。
(5)写出满足下列条件 F 的所有同分异构体的结构简式_________。
①能发生银镜反应;1molF 与 2molNaOH恰好反应。
②1H-NMR 谱显示分子中含有 5 种氢原子; IR 谱显示有-NH2,且与苯环直接相连。
(6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合理的路线制备阿司匹林(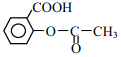 )。(用流程图表示,无机试剂任选)______。
)。(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.根据图①可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)正反应是吸热反应
2AB3(g)正反应是吸热反应
B.图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节至pH在4左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.相同条件下,测得![]() 溶液的pH大于相同物质的量浓度的
溶液的pH大于相同物质的量浓度的![]() 溶液,说明非金属性:
溶液,说明非金属性:![]()
B.绝热容器中,向50mL1![]() 的盐酸中加入烧碱,水的
的盐酸中加入烧碱,水的![]() 不变
不变
C.相同温度时,![]() 分别在相同物质的量浓度的
分别在相同物质的量浓度的![]() 溶液和
溶液和![]() 溶液中的溶解度相同
溶液中的溶解度相同
D.有HX和HY两种弱酸且酸性![]() ,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有
,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述不正确的是
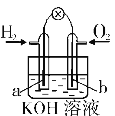
A.a极是负极,该电极上发生氧化反应
B.b极反应是O![]() +4OH
+4OH![]() -4e
-4e![]() =2H
=2H![]() O
O
C.总反应方程式为2H![]() +O
+O![]() =2H
=2H![]() O
O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.饱和氯水中加水稀释,促进氯水中水的电离
B.向氨水中加入氯化铵,由于氯化铵溶液呈酸性,所以溶液pH降低
C.碳酸钠溶液中存在CO32-+H2O![]() HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
D.向氢氧化镁悬浊液中加水稀释,Mg(OH)2沉淀溶解平衡正向移动,但c(Mg2+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是 ( )
A. 2.0 g D2O中含有的质子数、电子数均为NA
B. 室温下,7 g乙烯和丁烯的混合气体中所含的氢原子数目是NA
C. 室温下,2 L 0.05 mol·L-1 NH4NO3溶液中所含的氮原子数目是0.2NA
D. 256 g S8(分子结构如图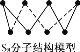 )含S—S键数目为7NA
)含S—S键数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )

A. ①浊液中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有SCN-
C. 该实验可以证明AgI比AgSCN更难溶
D. ③中颜色变化说明有AgI生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种绿色能源。如图所示,某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.

根据要求回答相关问题:
(1)写出负极的电极反应式__________________________________.
(2)铁电极为______(填“阳极”或“阴极” ),石墨电极(C)的电极反应式为______________.
(3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为______g。假设乙装置中溶液足量,若在标准状况下有448mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将增加_______g.
(4)若将乙装置中两电极位置互换,其他装置不变,此时乙装置中发生的总反应式________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com