
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.根据图①可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)正反应是吸热反应
2AB3(g)正反应是吸热反应
B.图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节至pH在4左右。
【答案】D
【解析】
A、图①中,交点之前,反应并未达平衡,交点时处于平衡状态,平衡后,升高温度,逆反应速率比正反应速率大,即平衡逆向移动,则正反应是放热反应,A错误;
B、图②中,乙达平衡时间较短,说明改变某条件乙的速率加快,但平衡时反应物的转化率不变,即改变条件平衡不移动,对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s),若改变的条件是增大压强,反应速率加快,但平衡向正反应移动,反应物的转化率增大,与图象不符合,B错误;
3C(g)+D(s),若改变的条件是增大压强,反应速率加快,但平衡向正反应移动,反应物的转化率增大,与图象不符合,B错误;
C、乙酸溶液中通入氨气生成乙酸铵,由弱电解质变为强电解质,溶液的导电能力增强,增强到最大值后,导电能力不再改变,与图象不符合,C错误;
D、由图④可知,Fe 3+在pH=4左右完全沉淀,此时铜离子不沉淀,则若除去CuSO 4溶液中的Fe3+可向溶液中加入适量 CuO,至pH在4左右,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在绝热恒容密闭容器一定条件下使反应2A(g)+B(s)![]() 3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
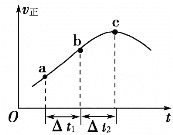
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应ΔH>0
D.Δt1=Δt2时,a~b段消耗A的量小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
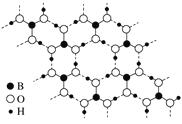
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__________;第一电离能I1(Si) ____ I1(Ge)(填“>”或“<”)。
(2)基态Ge原子核外电子排布式为_____________;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是________,原因是______。
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为________;硼酸在热水中比在冷水中溶解度显著增大的主要原因是_____________。
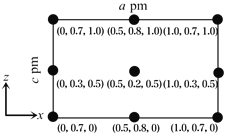
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为a pm,b pm和c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_______;CsSiB3O7的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____________g·cm-1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③0.1 mol/L NH4HSO4 ④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O,请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”“碱”或“中”),其原因是_____________(用离子方程式表示)
(2)在溶液④中______离子的浓度为0.1mol/L;NH3·H2O和_____离子的量浓度之和为0.2mol/L。
(3)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_______(填“>”“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)______c(NH4+)
(4)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式________。
②若溶液M由10mL 2mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”)。
(5)已知:在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液。回答下列问题:
①两溶液中,c(H+)·c(OH-)=__________。
②各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液。
③各取5mL上述溶液,分别加热到90℃,pH较小的是__________溶液。
④H2SO4和NH4Cl两溶液中,由水电离出的c(H+)分别为__________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是![]()
A.HF是卤族元素的氢化物中沸点最高的,因为HF分子间存在氢键,所以![]() 也是同族元素氢化物中沸点最高的
也是同族元素氢化物中沸点最高的
B.NaCl与浓硫酸加热可制得HCl,推测NaI与浓硫酸加热可制得HI
C.因为AgCl、AgBr、AgI均难溶,推测AgF也难溶于水
D.由于还原性![]() ,推测还原性
,推测还原性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如右图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是
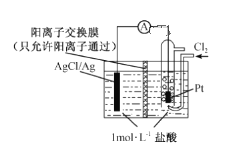
A.正极反应AgCl +e-= Ag+Cl-
B.正极反应Cl2 +2e- +2Ag+=2AgCl
C.放电时右侧盐酸的浓度变大
D.当电路中转移0.01 mol e-时,析出沉淀1.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_______________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_______________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com