
【题目】为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )

A. ①浊液中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有SCN-
C. 该实验可以证明AgI比AgSCN更难溶
D. ③中颜色变化说明有AgI生成
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的![]()
C. 应用盖斯定律可计算某些难以直接测量的反应焓变
D. 1g碳与适量水蒸气反应生成 CO和H2,吸收10.94kJ热量,则热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 某温度下,蒸馏水中的[H+]=1.0×10—6mol·L—1,则该温度一定高于25℃
B. 25℃时,pH=13的氢氧化钡溶液中,由水电离出来的[H+]=1.0×10—13mol·L—1,此时由水电离出来的[OH—]![]() [H+]
[H+]
C. 25℃时,水中加入氢氧化钠固体,水的电离平衡逆向移动,水的离子积减小
D. 25℃时,0.1 mol·L—1的盐酸与0.1mol·L—1的NaOH溶液中,水的电离程度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______族,其基态原子中未成对电子个数为________。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________,所含非金属元素的电负性由大到小的顺序是_____________________________。
(3)尿素[CO(NH2)2]分子中,碳原子为_______杂化,分子中σ键与π键的数目之比为_________。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为__________。

(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为__________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物A,已知其中可能含有MgCl2、CuSO4、CaCO3、FeCl3四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(假设过程中所有发生的反应都恰好完全进行)。
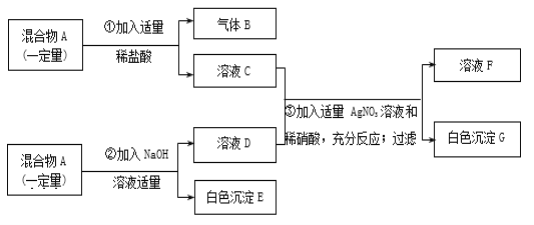
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为______。
(2)在混合物A里,上述四物质中肯定不存在的物质是_____(写化学式)。
(3)在溶液F中,主要含有___种溶质,其中大量含有的酸根离子符号是____。
(4)写出1个生成白色沉淀G的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)已知Ksp(BaCO3) =2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp _________(填“大于”、“小于”或“等于”)其在20 mL 0.01 mol·L-1 BaCl2溶液中的Ksp
②现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______mol/L。
③向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中c(CO32—)/c(SO42—)=___________(保留三位有效数字)。
(2)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是_______________。(填写序号);b中氯离子的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)、如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
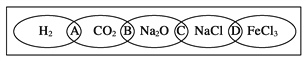
(1)请将分类依据代号填入相应的括号内:
(______)两种物质都不是电解质
(______)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是________________________________________。
(Ⅱ)反应:A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水是氧化剂的是______,水是还原剂的是________。(填序号)
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O,还原剂与氧化剂的物质的量之比:_______,当有0.6mol电子转移时。生成的NO在标准状况的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:
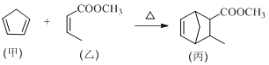
下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com