
ЎѕМвДїЎїУРТ»№ММе»мєПОпAЈ¬ТСЦЄЖдЦРїЙДЬє¬УРMgCl2ЎўCuSO4ЎўCaCO3ЎўFeCl3ЛДЦЦОпЦКЦРµДБЅЦЦ»т¶аЦЦЎЈ°ґИзНјЛщКѕЅшРРКµСйЈ¬іцПЦµДПЦПуИзНјЦРЛщКцЈЁјЩЙи№эіМЦРЛщУР·ўЙъµД·ґУ¦¶јЗЎєГНкИ«ЅшРРЈ©ЎЈ
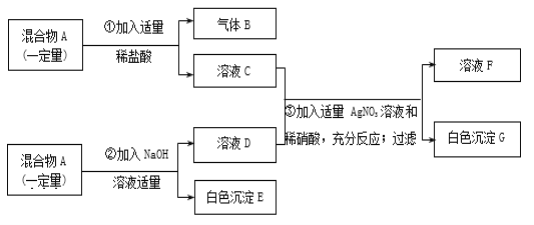
КФёщѕЭКµСй№эіМєН·ўЙъµДПЦПуЧціцЕР¶ПЈ¬МоРґТФПВїХ°ЧЈє
ЈЁ1Ј©ЖшМеBµД»ЇС§КЅОЄ______ЎЈ
ЈЁ2Ј©ФЪ»мєПОпAАпЈ¬ЙПКцЛДОпЦКЦРїП¶ЁІ»ґжФЪµДОпЦККЗ_____ЈЁРґ»ЇС§КЅЈ©ЎЈ
ЈЁ3Ј©ФЪИЬТєFЦРЈ¬ЦчТЄє¬УР___ЦЦИЬЦКЈ¬ЖдЦРґуБїє¬УРµДЛбёщАлЧУ·ыєЕКЗ____ЎЈ
ЈЁ4Ј©Рґіц1ёцЙъіЙ°ЧЙ«іБµнGµД»ЇС§·ЅіМКЅЈє_____ЎЈ
Ўѕґр°ёЎїCO2 CuSO4ЎўFeCl3 3 NO3- NaCl+AgNO3ЈЅAgClЎэ+NaNO3
ЎѕЅвОцЎї
ВИ»ЇМъєНЗвСх»ЇДЖ·ґУ¦ЙъіЙємєЦЙ«µДЗвСх»ЇМъіБµнЈ¬БтЛбНєНЗвСх»ЇДЖ·ґУ¦ЙъіЙА¶Й«ЗвСх»ЇНіБµнЈ¬ВИ»ЇГѕєНЗвСх»ЇДЖ·ґУ¦ЙъіЙ°ЧЙ«µДЗвСх»ЇГѕіБµнЈ¬МјЛбСОєНЛб·ґУ¦ЙъіЙ¶юСх»ЇМјЖшМеЈ¬ВИАлЧУєНТшАлЧУ·ґУ¦ЙъіЙ°ЧЙ«µДВИ»ЇТшіБµнЈ¬ЛщТФ»мєПОпAЦРТ»¶Ёє¬УРМјЛбёЖЈ¬МјЛбёЖєНСОЛб·ґУ¦ЙъіЙВИ»ЇёЖЎўЛ®єН¶юСх»ЇМјЈ¬ЛщТФBКЗ¶юСх»ЇМјЈ¬»мєПОпAЦРјУИлЗвСх»ЇДЖ»бЙъіЙ°ЧЙ«іБµнЈ¬ЛщТФAЦРТ»¶Ёє¬УРВИ»ЇГѕЈ¬ЗвСх»ЇДЖєНВИ»ЇГѕ·ґУ¦ЙъіЙЗвСх»ЇГѕіБµнєНВИ»ЇДЖЈ¬ВИАлЧУєНТшАлЧУ·ґУ¦ЙъіЙВИ»ЇТшіБµнЎЈ
ЈЁ1Ј©ёщѕЭТФЙП·ЦОцїЙЦЄЖшМеBµД»ЇС§КЅОЄCO2ЎЈ
ЈЁ2Ј©ФЪ»мєПОпAАпЈ¬ЙПКцЛДЦЦОпЦКЦРїП¶ЁІ»ґжФЪµДОпЦККЗЈєCuSO4ЎўFeCl3ЎЈ
ЈЁ3Ј©ФЪИЬТєFЦРЈ¬ЦчТЄє¬УРПхЛбДЖЎўПхЛбёЖЎўПЎПхЛб3ЦЦИЬЦКЈ¬ЖдЦРґуБїє¬УРµДЛбёщАлЧУ·ыєПКЗЈєNO3-ЎЈ
ЈЁ4Ј©ЙъіЙ°ЧЙ«іБµнGµД·ґУ¦КЗВИ»ЇДЖУлПхЛбТш·ґУ¦ЙъіЙВИ»ЇТшіБµнєНПхЛбДЖЈ¬»ЇС§·ЅіМКЅОЄЈєNaCl+AgNO3ЈЅAgClЎэ+NaNO3ЎЈ


 ФД¶БїміµПµБРґр°ё
ФД¶БїміµПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄЈєpKa=-lgKaЈ¬25ЎжК±Ј¬H2SO3µДpKa1=1.85Ј¬pKa2=7.19ЎЈУГ0.1 molЎ¤L-1NaOHИЬТєµО¶Ё20mL 0.1molЎ¤L-1H2SO3ИЬТєµДµО¶ЁЗъПЯИзПВНјЛщКѕ(ЗъПЯЙПµДКэЧЦОЄpH)ЎЈПВБРЛµ·ЁХэИ·µДКЗ

A. aµгЛщµГИЬТєЦРЈє2c(HSO3-)+c(SO32-)=0.1mol/L
B. bµгЛщµГИЬТєЦРЈєc(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. cµгЛщµГИЬТєЦРЈєc(Na+)>3c(HSO3-)
D. eµгЛщµГИЬТєЦРЈєc(Na+)> c(SO32-)> c(H+)> c(OH-)
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїГЮ»ЁєНСтГ«¶јѕЯУРµДМШµгКЗЈЁ Ј©
A.УцЕЁПхЛб¶јПФ»ЖЙ«
B.ЧЖЙХєуУРЙХЅ№УрГ«µДЖшО¶
C.ИјЙХІъОпЦ»УР¶юСх»ЇМјєНЛ®
D.ФЪТ»¶ЁМхјюПВДЬ·ўЙъЛ®Ѕв
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРёчЧйОпЦК»ҐОЄН¬·ЦТм№№МеµДКЗ
A.СхЖшєНіфСхB.ТТЛбУлјЧЛбјЧхҐC.16O єН 18OD.ТТґјєНјЧґј
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїКµСйКТЕдЦЖ1mol/LµДNaOHИЬТє240mLЈ¬
ЈЁ1Ј©КµСйІЩЧчЦРУГМмЖЅіЖБї___gNaOH№ММеЈ»
ЈЁ2Ј©ИЭБїЖїФЪК№УГЗ°µДІЩЧчКЗ___
ЈЁ3Ј©ИфКµСйК±УцµЅПВБРЗйїцЈ¬ЛщЕдИЬТєµДЕЁ¶ИЖ«ґуµДКЗ___ЎЈ
ўЩіЖБїЗвСх»ЇДЖ№ММеµДК±јд№эі¤ЎЈ ўЪИЭБїЖїУГХфБуЛ®ПґµУєуІРБфУРЙЩБїµДЛ®ЎЈ
ўЫИЬТєОґАдИґјґЧЄИлИЭБїЖїЎЈ ўЬФЪЧЄТЖЗвСх»ЇДЖИЬТєєуОґПґµУЙХ±ЎЈ
ўЭ¶ЁИЭК±ё©КУїМ¶ИПЯЎЈўЮТЎФИєуЈ¬·ўПЦИЬТєµДТєГжµНУЪїМ¶ИПЯЈ¬УЦјУЛ®ЦБїМ¶ИПЯЎЈ
ЈЁ4Ј©ИЎЕдЦЖµД1mol/LµДNaOHИЬТє10mLЈ¬ФЩПЎКНіЙ100mLЈ¬ФЩґУЦРИЎіц10mLЈ¬Хв10mLИЬТєµДОпЦКµДБїЕЁ¶ИОЄ____ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїОЄСРѕїіБµнµДЙъіЙј°ЖдЧЄ»ЇЈ¬ДіРЎЧйЅшРРИзПВКµСйЈ®№ШУЪёГКµСйµД·ЦОцІ»ХэИ·µДКЗЈЁЎЎЎЎЈ©

A. ўЩЧЗТєЦРґжФЪЖЅєвЈєAgSCNЈЁsЈ©Ag+ЈЁaqЈ©+SCN-ЈЁaqЈ©
B. ўЪЦРСХЙ«±д»ЇЛµГчЙПІгЗеТєЦРє¬УРSCN-
C. ёГКµСйїЙТФЦ¤ГчAgI±ИAgSCNёьДСИЬ
D. ўЫЦРСХЙ«±д»ЇЛµГчУРAgIЙъіЙ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїµзЅвЦКЛ®ИЬТєЦРґжФЪµзАлЖЅєвЎўЛ®ЅвЖЅєвЎўИЬЅвЖЅєвЈ¬Зл»ШґрПВБРОКМвЎЈ
ЈЁ1Ј©ТСЦЄІї·ЦИхЛбµДµзАліЈКэИзПВ±нЈє
ИхЛб | CH3COOH | HCN | H2CO3 |
µзАліЈКэ(25Ўж) | Ka = 1.8ЎБ10Ј5 | Ka=4.3ЎБl0-10 | Ka1=5.0ЎБl0-7 Ka2=5.6ЎБl0-11 |
ўЩ0.1 moI/L NaCNИЬТєєН0.1mol/L NaHCO3ИЬТєЦРЈ¬cЈЁCN-Ј©______cЈЁHCO3 -Ј©ЈЁМоЎ°>Ў±ЎўЎ°<Ў±»тЎ°=Ў±Ј©ЎЈўЪіЈОВПВЈ¬pHПаН¬µДИэЦЦИЬТєAЈ®CH3COONa BЈ®NaCN CЈ®Na2CO3Ј¬ЖдОпЦКµДБїЕЁ¶ИУЙґуµЅРЎµДЛіРтКЗ________ЈЁМо±аєЕЈ©ЎЈ
ўЫТСЦЄ25ЎжК±Ј¬CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2OЈЁ1Ј© ЎчH=-akJ/molЈ¬H+(aq) +OH-(aq) =H2OЈЁ1Ј© ЎчH=-b kJ/molЈ¬ґЧЛбµзАлµДИИ»ЇС§·ЅіМКЅОЄ________________________________________ЎЈ
ўЬЅ«ЙЩБїCO2НЁИлNaCNИЬТєЈ¬·ґУ¦µДАлЧУ·ЅіМКЅКЗ______________________________ЎЈ
ўЭКТОВПВЈ¬ЎЄ¶ЁЕЁ¶ИµДCH3COONaИЬТєpH=9Ј¬УГАлЧУ·ЅіМКЅ±нКѕИЬТєіКјоРФµДФТтКЗ________________Ј¬ИЬТєЦРc(CH3COOЎЄ)/c(CH3COOH)___________ЎЈ
ЈЁ2Ј©КТОВПВЈ¬УГ0.100 mol/LСОЛбИЬТєµО¶Ё20.00mL0.l00mol/L µДДі°±Л®ИЬТєЈ¬µО¶ЁЗъПЯИзНјЛщКѕЎЈ

ўЩdµгЛщКѕµДИЬТєЦРАлЧУЕЁ¶ИУЙґуµЅРЎµДЛіРтТАґООЄ_______________ЎЈ
ўЪbµгЛщКѕµДИЬТєЦРc(NH3Ў¤H2O)-c(NH4+)=__________ЈЁУГИЬТєЦРµДЖдЛьАлЧУЕЁ¶И±нКѕЈ©ЎЈ
ўЫpH =10µД°±Л®УлpH =4µДNH4C1ИЬТєЦРЈ¬УЙЛ®µзАліцµДc(H+)Ц®±ИОЄ____ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТ»¶ЁОВ¶ИПВЈ¬ФЪИэёцИЭ»эѕщОЄ 1.0 L µДєгИЭГЬ±ХИЭЖчЦР·ўЙъ·ґУ¦ЈєCH3OH(g)+CO(g) CH3COOH(g) ¦¤H<0ЎЈПВБРЛµ·ЁХэИ·µДКЗ
ИЭЖч±аєЕ | ОВ¶И/K | ОпЦКµДЖрКјЕЁ¶И/mol/L | ОпЦКµДЖЅєвЕЁ¶И/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. ґпЖЅєвК±Ј¬ИЭЖч I УлИЭЖч II ЦРµДЧЬС№ЗїЦ®±ИОЄ 3 : 4
B. ґпЖЅєвК±Ј¬ИЭЖч II ЦР ![]() ±ИИЭЖч I ЦРµДРЎ
±ИИЭЖч I ЦРµДРЎ
C. ґпЖЅєвК±Ј¬ИЭЖчўуЦРµДХэ·ґУ¦ЛЩВК±ИИЭЖч I ЦРµДґу
D. ґпЖЅєвК±Ј¬ИЭЖч I ЦРCH3OH ЧЄ»ЇВКУлИЭЖч III ЦР CH3COOH ЧЄ»ЇВКЦ®єНРЎУЪ 1
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїјёЦЦОпЦКµДПВБРУ¦УГМеПЦЖд»№ФРФµДКЗ
A.Мъ·ЫЧчКіЖ·ґьДЪµДНССхјБB.ЗвСх»ЇВБЧчОёЛбЦРєНјБ
C.Л®ІЈБ§УГЧчДѕІД·А»рјБD.ClO2УГУЪЧФАґЛ®Пы¶ѕ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com