
【题目】一定温度下,在三个容积均为 1.0 L 的恒容密闭容器中发生反应:CH3OH(g)+CO(g) CH3COOH(g) ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器 I 与容器 II 中的总压强之比为 3 : 4
B. 达平衡时,容器 II 中 ![]() 比容器 I 中的小
比容器 I 中的小
C. 达平衡时,容器Ⅲ中的正反应速率比容器 I 中的大
D. 达平衡时,容器 I 中CH3OH 转化率与容器 III 中 CH3COOH 转化率之和小于 1
【答案】D
【解析】
A.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6( mol/L),因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0.72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;
CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6( mol/L),因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0.72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;
B.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则
CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则![]() 增大,则达平衡时,容器II中
增大,则达平衡时,容器II中![]() 比容器I中的大,故B错误;
比容器I中的大,故B错误;
C.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;
D. 根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故D正确;
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故D正确;
答案选D。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】飞机C919是我国自行研制的,标志着我国飞机制造技术的飞跃。请回答问题:
(1)利用CO还原赤铁矿石可制得铁单质,其反应的化学方程式为____。
(2)飞机上使用的螺丝钉一般不用铁制的,其原因是因为铁与____反应易生锈。
(3)铝比铁活泼,但铝制品耐腐蚀的原因是____。
(4)航空煤油是将石油通过____(分馏或干馏)提炼出来的,飞行过程中主要是 ___能转化为机械能。
(5)C919的厨房为乘客提供了以下食物:快餐、雪碧、牛奶、蔬菜面条等。上述食物中属于溶液的是____,蔬菜面条比普通面条多提供的营养物质主要是____和矿物质。
(6)飞机急救箱中还准备消毒剂过氧化氢溶液,过氧化氢中氧元素的化合价为____。
(7)飞机上的座椅套采用耐磨、耐腐蚀的“尼龙”属于____材料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物A,已知其中可能含有MgCl2、CuSO4、CaCO3、FeCl3四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(假设过程中所有发生的反应都恰好完全进行)。
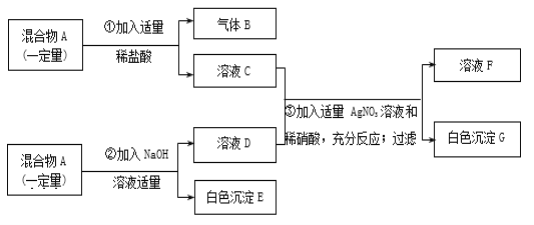
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为______。
(2)在混合物A里,上述四物质中肯定不存在的物质是_____(写化学式)。
(3)在溶液F中,主要含有___种溶质,其中大量含有的酸根离子符号是____。
(4)写出1个生成白色沉淀G的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
(2)写出下列反应的离子方程式:
①金属A和水__________________________________________。
②物质B和气体乙_______________________________________。
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因_______________________。
(4)用化学方程式解释F长期放置在空气中失效的原因___________________________。
(5)红热细铁丝能在气体乙剧烈燃烧,现象是____________________,将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在_________之间。向氢氧化铁胶体中滴入过量稀硫酸,现象是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)、如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
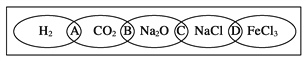
(1)请将分类依据代号填入相应的括号内:
(______)两种物质都不是电解质
(______)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是________________________________________。
(Ⅱ)反应:A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水是氧化剂的是______,水是还原剂的是________。(填序号)
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O,还原剂与氧化剂的物质的量之比:_______,当有0.6mol电子转移时。生成的NO在标准状况的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的离子方程式为:________________,该盐酸的物质的量浓度为___________mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目:___________________________。
(3)8.7gMnO2与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______。
(4)浓盐酸在反应中显示出来的性质是__________(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1。则相同条件下破坏1mol NO分子中的化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
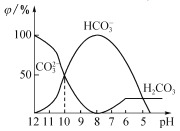
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com