
【题目】用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的离子方程式为:________________,该盐酸的物质的量浓度为___________mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目:___________________________。
(3)8.7gMnO2与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______。
(4)浓盐酸在反应中显示出来的性质是__________(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
【答案】MnO2+4H++2Cl-=Mn2+ + Cl2↑+2H2O 11.9  0.2 MnO2 Mn2+ a b
0.2 MnO2 Mn2+ a b
【解析】
(1)根据化学反应方程式可知该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O:根据
Mn2++Cl2↑+2H2O:根据![]() 可知该盐酸的物质的量浓度为
可知该盐酸的物质的量浓度为![]() =11.9mol/L。(2)反应中氯元素化合价从-1价升高到0价,Mn元素化合价从+4价降低到+2价,所以用双线桥法表示出该反应的电子转移方向和数目为
=11.9mol/L。(2)反应中氯元素化合价从-1价升高到0价,Mn元素化合价从+4价降低到+2价,所以用双线桥法表示出该反应的电子转移方向和数目为 。(3)8.7gMnO2的物质的量是8.7g÷87g/mol=0.1mol,根据电子得失守恒可知与足量浓盐酸反应能使0.2molHCl被氧化;其中还原过程为MnO2→Mn2+。(4)根据方程式可知还有氯化锰生成,所以浓盐酸在反应中显示出来的性质是酸性和还原性,答案选ab。
。(3)8.7gMnO2的物质的量是8.7g÷87g/mol=0.1mol,根据电子得失守恒可知与足量浓盐酸反应能使0.2molHCl被氧化;其中还原过程为MnO2→Mn2+。(4)根据方程式可知还有氯化锰生成,所以浓盐酸在反应中显示出来的性质是酸性和还原性,答案选ab。


科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。②常温下,pH相同的三种溶液A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2O(1) △H=-akJ/mol,H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol,醋酸电离的热化学方程式为________________________________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________________。
⑤室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是________________,溶液中c(CH3COO—)/c(CH3COOH)___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=__________(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为 1.0 L 的恒容密闭容器中发生反应:CH3OH(g)+CO(g) CH3COOH(g) ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器 I 与容器 II 中的总压强之比为 3 : 4
B. 达平衡时,容器 II 中 ![]() 比容器 I 中的小
比容器 I 中的小
C. 达平衡时,容器Ⅲ中的正反应速率比容器 I 中的大
D. 达平衡时,容器 I 中CH3OH 转化率与容器 III 中 CH3COOH 转化率之和小于 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(氧化铁)颜料的工艺流程如图所示。

(1)反应Ⅰ的离子方程式为_____________,该反应的氧化剂是________________。
(2)反应Ⅱ的离子方程式为_________________________。
(3)反应Ⅵ是在45~50℃的条件下进行的,写出该反应的化学方程式:__________________。
(4)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O,为测定某碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=﹣lgc(OH﹣),298K时,向20.00mL0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是
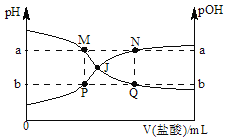
A. M、P两点的数值之和a+b=14
B. M点水的电离程度比Q点大
C. 曲线PJN表示溶液中pH的变化
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现,普通盐水在无线电波的照射下可以降低盐水中所含元素之间的结合力,释放出氢原子,点火时氢原子会在该频率下持续燃烧。上述“结合力”的实质是( )
A.离子键B.共价键C.金属键D.分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com