
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(氧化铁)颜料的工艺流程如图所示。

(1)反应Ⅰ的离子方程式为_____________,该反应的氧化剂是________________。
(2)反应Ⅱ的离子方程式为_________________________。
(3)反应Ⅵ是在45~50℃的条件下进行的,写出该反应的化学方程式:__________________。
(4)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O,为测定某碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为___________(填化学式)。
【答案】 CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2S FeCl3(或Fe3+) , CuFeS2 Fe2++2HCO3-= FeCO3+H2O+CO2↑ 4 CuCl +O2+8H2O ![]() 2[Cu2(OH)2Cl2·3H2O] Cu2((OH)3Cl·H2O
2[Cu2(OH)2Cl2·3H2O] Cu2((OH)3Cl·H2O
【解析】(1). 由反应流程可知,反应Ⅰ的反应物是CuFeS2和FeCl3,产物有CuCl和S,结合反应II可知,反应I生成的产物有Fe2+,则根据得失电子守恒和原子守恒,反应I的离子方程式为:CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2S,在该反应中,铁元素和铜元素的化合价降低,所以氧化剂是FeCl3(或Fe3+) 、CuFeS2,故答案为:CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2S;FeCl3(或Fe3+) 、CuFeS2;
(2).根据(1)的分析并结合流程图可知,反应Ⅱ中反应物是Fe2+和HCO3-,产物为碳酸亚铁,该反应的离子方程式为: Fe2++2HCO3-= FeCO3+H2O+CO2↑,故答案为: Fe2++2HCO3-= FeCO3+H2O+CO2↑;
(3).反应Ⅵ是在45~50 ℃的条件下进行的,根据流程图可知,该反应的反应物是CuCl、H2O和O2,产物是Cu2(OH)2Cl2·3H2O,在该反应中,铜元素的化合价升高,CuCl是还原剂,O2是氧化剂,则根据得失电子守恒和原子守恒,反应VI的化学方程式为:4 CuCl +O2+8H2O ![]() 2[Cu2(OH)2Cl2·3H2O],故答案为:4 CuCl +O2+8H2O
2[Cu2(OH)2Cl2·3H2O],故答案为:4 CuCl +O2+8H2O ![]() 2[Cu2(OH)2Cl2·3H2O];
2[Cu2(OH)2Cl2·3H2O];
(4).由实验②可求出:n(Cl)=n(AgCl)×![]() =
=![]() ×
×![]() =0.04mol,由实验③并结合反应Cu2++H2Y2-=CuY2-+2H+可求出:n(Cu2+)=n(EDTA)×
=0.04mol,由实验③并结合反应Cu2++H2Y2-=CuY2-+2H+可求出:n(Cu2+)=n(EDTA)×![]() =0.40mol·L-1×0.05000 L×
=0.40mol·L-1×0.05000 L×![]() =0.08 mol,根据化合物中电荷守恒得:n(OH)=2n(Cu2+)n(Cl)=2×0.08mol0.04 mol=0.12 mol,则m(Cl)=0.04 mol×35.5 g/mol=1.42 g,m(Cu2+)=0.08 mol×64 g/mol=5.12 g,m(OH)=0.12 mol×17 g/mol=2.04 g,所以n(H2O)=(9.30g1.42g5.12g2.04g)÷18g/mol=0.04 mol,则a:b:c:x=n(Cu2+):n(OH):n(Cl):n(H2O)=2:3:1:1,即化学式为Cu2((OH)3Cl·H2O,故答案为:Cu2((OH)3Cl·H2O。
=0.08 mol,根据化合物中电荷守恒得:n(OH)=2n(Cu2+)n(Cl)=2×0.08mol0.04 mol=0.12 mol,则m(Cl)=0.04 mol×35.5 g/mol=1.42 g,m(Cu2+)=0.08 mol×64 g/mol=5.12 g,m(OH)=0.12 mol×17 g/mol=2.04 g,所以n(H2O)=(9.30g1.42g5.12g2.04g)÷18g/mol=0.04 mol,则a:b:c:x=n(Cu2+):n(OH):n(Cl):n(H2O)=2:3:1:1,即化学式为Cu2((OH)3Cl·H2O,故答案为:Cu2((OH)3Cl·H2O。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】G是一种常见的氨基酸,其合成路线如图:
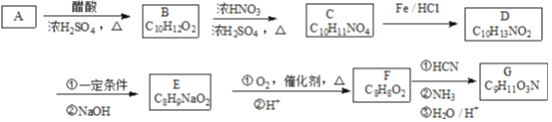
已知以下信息:
①A苯环上只有1个取代基且核磁共振氢谱有6组峰,其面积之比为1:2:2:2:2:1;D和F的苯环上的一氯代物都只有2种;
②F、G能与FeCl3溶液发生显色反应,F能发生银镜反应;
③ 。
。
回答下列问题:
(1)B的名称为____________。
(2)F→G的过程中①的反应类型是____________。
(3)B→C 反应的化学方程式为____________。
(4)G的结构简式为____________。
(5)F含有苯环且能发生水解反应的同分异构体有____种,其中核磁共振氢谱有4組峰,且面积之比为3:2:2:1的是____________。
(6)参照本题中的合成路线,请以乙烯为原料,合成丙氨酸(![]() );写出合成路线的流程图(无机试剂可任选) ________。合成流程图示例如下:
);写出合成路线的流程图(无机试剂可任选) ________。合成流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
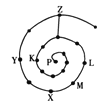
A. Y元素的氢化物的热稳定性比Z元素的氢化物差
B. K、Z两元素的氢化物的水溶液都显酸性
C. L、M、X三元素位于同一族
D. K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 
(1)该浓盐酸中HCl的物质的量浓度为 . 若用KMnO4氧化上述 HCl.其反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1mol KMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl﹣的物质的量浓度为
(3)8mol HCl完全反应,产生的Cl2在标准状况下的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为( )
A.1.0mol/L
B.2.0mol/L
C.3.0mol/L
D.4.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()
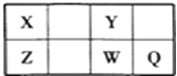
A. 钠与W可能形成Na2W2化合物
B. 由Z与Y组成的物质在熔融时能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒对紫外线和热敏感,有些方法还是可以有效灭活病毒的,下列做法错误的是( )
A.56℃以上加热30min
B.95%的酒精
C.含氯消毒剂(如84消毒液)
D.过氧乙酸和氯仿等脂溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下: Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液 ![]() 无明显现象
无明显现象 ![]() 溶液变红
溶液变红
实验2:0.1mol/L FeCl3溶液 ![]() 溶液变红
溶液变红 ![]() 溶液红色未褪去
溶液红色未褪去
(1)写出Fe(OH)2Cl与盐酸反应的离子方程式 .
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 .
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下: 步骤1:10mL 0.1mol/L KI溶液 ![]() 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液 ![]() 溶液变红
溶液变红
试管2 取3mL黄色溶液 ![]() 溶液变蓝
溶液变蓝
试管3 取3mL黄色溶液 ![]() 取上层溶液
取上层溶液 ![]() 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是 .
②黄色溶液中含有的溶质微粒有K+、Cl﹣ 和 .
③综合上述实验现象,得出的实验结论是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com