
【题目】化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:
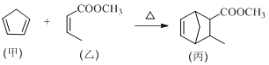
下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
【答案】D
【解析】
A.甲分子中含有饱和碳原子,由于饱和碳原子构成的是正四面体结构,与该C原子连接的原子最多有2个在这一平面上,所以不可能所有原子都在同一平面上,A错误;
B.乙分子中含有C=C和酯基,只有C=C双键可与H2发生加成反应,二者反应的物质的量的比为1:1,B错误;
C.丙物质含有不饱和的碳碳双键,可以被酸性高锰酸钾溶液溶液氧化而使溶液褪色,也可以与溴的CCl4溶液发生加成反应而使溶液褪色,褪色原理不同,C错误;
D.甲分子式是C5H6,1mol甲完全燃烧消耗O2的物质的量为6.5mol,乙化学式为C5H8O2,1mol乙完全燃烧消耗O2的物质的量为6mol,所以等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )

A. ①浊液中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有SCN-
C. 该实验可以证明AgI比AgSCN更难溶
D. ③中颜色变化说明有AgI生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(氧化铁)颜料的工艺流程如图所示。

(1)反应Ⅰ的离子方程式为_____________,该反应的氧化剂是________________。
(2)反应Ⅱ的离子方程式为_________________________。
(3)反应Ⅵ是在45~50℃的条件下进行的,写出该反应的化学方程式:__________________。
(4)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O,为测定某碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-17
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH 溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
(1)常温下,在 pH = 5 的稀醋酸溶液中,c(CH3COO-)=_____(不必化简)。下列方法中,可以使 0.10 mol·L-1 CH3COOH 的电离程度增大的是_____
a.加入少量 0.10 mol·L-1 的稀盐酸 b.加热 CH3COOH 溶液
c.加水稀释至 0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量 0.10 mol·L-1 的 NaOH 溶液
(2)将等质量的锌投入等体积且 pH 均等于 3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_____V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。(填写“>”、“<”或“=”)
(3)已知:90℃时,水的离子积常数为 Kw=3.8×10-13,在此温度下,将 pH=3 的盐酸和 pH=11 的氢氧化钠溶液等体积混合,则混合溶液中的 c(H+)=_____mol/L(保留三位有效数字)。
Ⅱ.(1)常温下,已知 0.1 mol·L-1 一元酸HA 溶液中c(OH-)/c(H+)=1×10-8。常温下,0.1mol·L-1 HA溶液的 pH=_____;
(2)常温下,向 pH=a 的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的 pH_____(14-a)(填写“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+3B===2C+D的反应中,表示反应速率最快的是( )
A. v(A)=0.5 mol·L-1·min-1B. v(B)=0.6 mol·L-1·min-1
C. v(C)=0.35 mol·L-1·min-1D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com