
【题目】温度相同,浓度均为0.1 mol·L-1的:①(NH4)2CO3,②(NH4)2Fe(SO4)2,③氨水,④NH4NO3,⑤ NH4HSO4溶液,它们中的c(NH![]() )由大到小的排列顺序是( )
)由大到小的排列顺序是( )
A. ②⑤④①③ B. ③⑤②④①
C. ②①⑤④③ D. ⑤②①④③
科目:高中化学 来源: 题型:
【题目】11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68L CO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
A.80%B.60%C.40%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l) === 2HI(aq) + H2SO4(aq) ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) === SO2(g) + H2O(l) + ![]() O2(g) ΔH2 = +327 kJ·mol-1
O2(g) ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) === H2(g) + I2(g) ΔH3 = +172 kJ·mol-1
下列说法不正确的是:
A. 该过程实现了太阳能到化学能的转化
B. SO2和I2对总反应起到了催化剂的作用
C. 总反应的热化学方程式为:2H2O(l) === 2H2 (g)+O2(g) ΔH = +286 kJ·mol-1
D. 该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。A、B、C同周期,且A元素原子核外s能级有1个未成对电子;C元素的原子序数比B多1,且C元素的原子核外p电子比s电子少1;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾;E元素的原子序数为27。请回答下列问题:
(1)第一电离能介于A和C之间的同周期元素有________________(填元素符号)。
(2)C元素的最高价氧化物所对应的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为____________,写出任意一种与该阴离子互为等电子体的微粒的化学式___________。
(3)与B元素同主族的元素硅,其四卤化物的沸点和铅的二卤化物熔点如图所示:
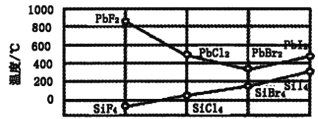
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________________。
②结合PbX2的熔点的变化规律,推断如下物质的熔点高低:NaCl_______MgO(填“<”、“>”或“=”)。
(4)元素D可以形成如图所示的配合物,该配合物中所含化学键的类型不包括________(填字母)。
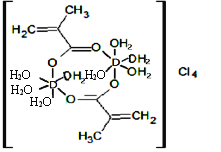
a、极性共价键 b、非极性共价键 c、配位键 d、离子键
e、金属键 f、σ键 g、π键
(5)已知E3+可形成配位数为6的配合物。现有橙黄色和紫红色两种E的配合物,其组成均可表示为ECl3·nNH3。为测定这两种配合物晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现紫红色晶体产生沉淀的质量与橙黄色晶体产生沉淀的质量之比为2∶3 。则紫红色晶体的化学式为______________(用配合物的形式写出化学式,且E用元素符号表示,n用具体数字表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.苯是环状结构,其性质是环烷烃相似
B.![]() 表示苯分子的结构,其中含有碳碳双键,因此苯的性质跟烯烃相同
表示苯分子的结构,其中含有碳碳双键,因此苯的性质跟烯烃相同
C.苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和溴水反应
D.苯能使溴水退色是因为发生了萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
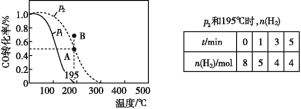
A.0~3 min,平均速率v(CH3OH)=0.8 mol·L-1·min-1
B.p1<p2,ΔH>0
C.在p2和195 ℃时,该反应的平衡常数为25( mol·L-1)-2
D.在B点时,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)写出下列反应的化学方程式。
①乙烯通入溴的四氯化碳溶液中:___。
②苯与液溴在铁粉作用下发生反应:___。
(2)苯可以和浓硫酸发生取代反应生成苯磺酸(![]() ),根据质量守恒定律,可判断出另一种产物为___。
),根据质量守恒定律,可判断出另一种产物为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1KOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。下列说法正确的是( )

A. a点所得溶液中:2c(H2A)+c(A2-)=0.1mol/L
B. b点所得溶液中:2c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c点所得溶液中:c(K+)<3c(HA-)
D. d点所得溶液中A2-第一级水解平衡常数为10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据如图判断该反应的△H___________0(填“>”“<”或“=”),理由是___________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=___________,反应的平衡常数K=______(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为___________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com