
【题目】按要求完成下列问题:
(1)写出下列反应的化学方程式。
①乙烯通入溴的四氯化碳溶液中:___。
②苯与液溴在铁粉作用下发生反应:___。
(2)苯可以和浓硫酸发生取代反应生成苯磺酸(![]() ),根据质量守恒定律,可判断出另一种产物为___。
),根据质量守恒定律,可判断出另一种产物为___。
【答案】CH2=CH2+Br2→CH2BrCH2Br ![]() +Br2
+Br2![]()
![]() +HBr H2O
+HBr H2O
【解析】
(1)①乙烯含有碳碳双键,与溴发生加成反应;
②苯与浓硫酸及浓硝酸在50~60℃时发生取代反应,苯环上的一个氢原子被硝基取代,生成硝基苯和水;
(2)根据质量守恒定律及取代反应的定义确定另一种生成物。
(1)①乙烯含有碳碳双键,与溴发生加成反应,化学方程式为:CH2=CH2+Br2→CH2BrCH2Br;
②苯与浓硫酸及浓硝酸在5060℃时发生取代反应,苯环上的一个氢原子被硝基取代,反应方程式为:![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(2)苯可以和浓硫酸发生取代反应生成苯磺酸,发生取代反应,苯中被取代的H与硫酸中OH结合,由质量守恒定律可知生成水H2O。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如下。
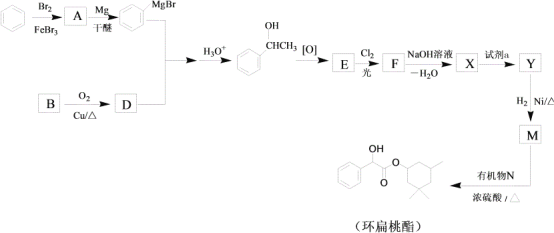
已知:RX ![]() R-MgX
R-MgX (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
(1)A 的结构简式是___________________
(2)B → D 的化学方程式是________________
(3)红外吸收光谱表明 E 有 C=O 键。 F 的分子式为 C8H6Cl2O 。
①E 的结构简式是________
②E → F 的反应类型是________
(4)X 的结构简式是________
(5)试剂 a 是________
(6)生成环扁桃酯的化学方程式是________
(7)以 CH3CH=CH 2 、 CH3CHO 为有机原料, 结合题目所给信息 ,选用必要的无机试剂合成 CH2=CHCH=CHCH3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
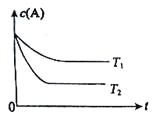
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.1 mol·L-1的:①(NH4)2CO3,②(NH4)2Fe(SO4)2,③氨水,④NH4NO3,⑤ NH4HSO4溶液,它们中的c(NH![]() )由大到小的排列顺序是( )
)由大到小的排列顺序是( )
A. ②⑤④①③ B. ③⑤②④①
C. ②①⑤④③ D. ⑤②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少二氧化碳的排放、氮氧化物、二氧化硫的处理与利用是一项重要的热点课题。CO2经催化加氢可合成低碳烯烃:![]() 在
在![]() 时,按
时,按![]() :
:![]() :3投料,如图所示不同温度
:3投料,如图所示不同温度![]() 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量![]() 的关系。
的关系。
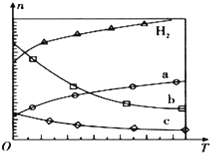
(1)该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
(2)曲线b表示的物质为 ______
(3)为提高![]() 的平衡转化率,除改变温度外,还可采取的措施是 ______
的平衡转化率,除改变温度外,还可采取的措施是 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原法可以处理氮氧化物。如反应:![]()
![]() 。在
。在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
(1)T1℃时,该反应的平衡常数![]() ______
______
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 答一种即可
答一种即可![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,H3A水溶液(一种酸溶液)中含A的各种粒子的分布分数[平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)]与pH的关系如图所示。下列叙述正确的是( )
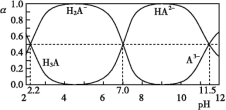
A.根据图,可得Ka1(H3A)≈10-7
B.将等物质的量的NaH2A和Na2HA混合物溶于水,所得的溶液中α(H2A-)=α(HA2-)
C.以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入H3A溶液中,当溶液由无色变为浅红色时停止滴加,则生成NaH2A
D.在上述含A的各种粒子的体系中,若溶液pH为11.5时,则c(H2A-)+5c(A3-)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
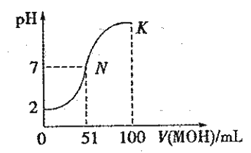
(1)由图中信息可知HA为 酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH = a,则a______________7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: _____________________,此时,溶液中由水电离出的c(OH-)=_________
(3)请写出K点所对应的溶液中离子浓度的大小关系______________________。
(4)K点对应的溶液中,溶液的 pH = 10,则 c(MOH) +c(OH-) =_________________mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com