
【题目】某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下水的离子积为______。
(2)该温度下0.01 mol/L NaOH溶液的pH为____。
(3)该温度下,将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,混合溶液呈中性,则Va﹕Vb=_______
【答案】1×10-15mol2L-2 13 10﹕1
【解析】
(1)离子积常数Kw=c(H+)·c(OH-);
(2)根据该温度下水的离子积常数计算NaOH溶液的pH;
(3)混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,据此计算Va﹕Vb。
(1)根据图知,当c(H+)=1×10-5mol/L,c(OH-)=1×10-10mol/L,由离子积常数Kw=c(H+)·c(OH-)=1×10-5mol/L×1×10-10mol/L=1×10-15mol2L-2,故答案为:1×10-15mol2L-2。
(2)该温度下,氢氧化钠溶液中氢离子浓度=1×10-15mol2L-2÷0.01mol/L=10-13mol/L,pH=13,故答案为:13。
(3)pH=12的NaOH溶液中c(H+)=10-12mol/L
则氢氧化钠溶液中c(OH-)=Kw/c(H+)=10-15(mol/L)2/10-12mol/L=10-3mol/L
pH=2的硫酸中c(H+)=10-2mol/L,
若所得混合液为中性,则c(H+)×Vb=c(OH-)×Va,
Va:Vb=10-2:10-3=10:1。
故答案为:10﹕1。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是
A. 1. 0mol·L-1 AlCl3的溶液中含Al3+的数目小于0. 1NA
B. 0. 5mol环己烷中含非极性键的数目为2. 5NA
C. 30g由葡萄糖和乳酸(C3H6O3)组成的混合物中含氢原子数目为2NA
D. 7. 1g Cl2完全反应转移的电子数一定为0. 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L 的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)该反应的化学方程式为:______________________。
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=____________。
(3)1min时,正逆反应速率的大小关系为:v正____________v逆(填“>”、“<”或“=”);4min时,v正____________v逆(同前);若X、Y、Z均为气体,反应达到平衡时:若此时将容器的体积缩小为原来的1/2倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
(4)上述反应在t1~t6内反应速率与时间图像如图,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是____________。

A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时X的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.向等质量的Na2CO3和NaHCO3 固体中分别加入足量盐酸,后者产生的CO2多
C.可用相同的离子方程式表示Na2CO3和NaHCO3分别与硝酸的反应
D.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容下的反应:2AB(g)![]() 3A2(g)+B2(g),能说明此反应达到平衡是
3A2(g)+B2(g),能说明此反应达到平衡是
A.混合气体的平均摩尔质量不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.AB的消耗速率等于A2的消耗速率
D.单位时间内生成3nmolA2,同时消耗2nmolAB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣是一种重要的化工产业中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m的流程图:
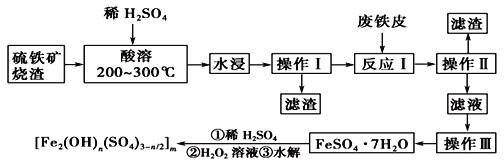
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有__________、玻璃棒和烧杯等。“操作Ⅲ”系列操作名称依次为________、________、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学方程式:___________________________________。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是____________________________。
(4)实验室检验“反应Ⅰ”已经完全的试剂是__________,现象是_______________。
(5)加入适量H2O2溶液的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:

反应 CO2(g) + H2(g) ![]() CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) ![]() CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
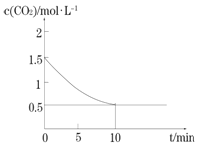
①该条件下反应的平衡常数为________________________________________;
②下列措施中能使平衡时c(CO)/c(CO2)增大的是______________________________________(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________________________________(填字母)。
a.容器中压强不变 b.气体的密度不再改变 c.υ正(CO2)= υ逆(CO)
d.c(CO2)= c(CO) e.容器内气体总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。
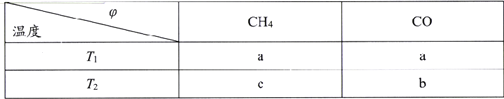
已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:

由上表判断,应选择载体为_______(填化学式),理由是________。
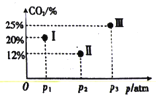
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。
(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
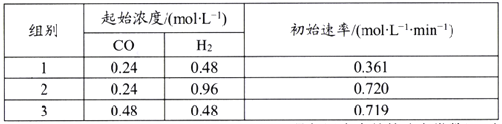
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com