
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。
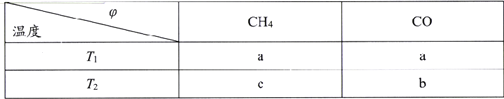
已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:

由上表判断,应选择载体为_______(填化学式),理由是________。
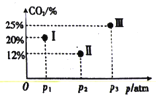
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。
(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
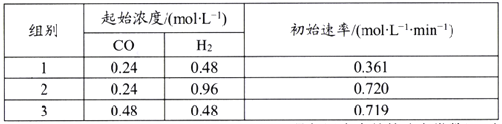
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
【答案】+247.1 升高温度 < ![]() MgO 此条件下合成气产率高 III 1 0.2mol/(L·min)
MgO 此条件下合成气产率高 III 1 0.2mol/(L·min)
【解析】
(1)依据盖斯定律作答;
(2)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)反应吸热,依据外因对化学反应速率与化学平衡的综合影响来分析;结合表格数据,依据升高温度对物质体积分数的影响效果判断温度高低,再利用甲烷与CO的平衡体积分数相等计算出转化的甲烷的物质的量,列出三段式,根据平衡常数的表达式计算解答;
2CO(g)+2H2(g)反应吸热,依据外因对化学反应速率与化学平衡的综合影响来分析;结合表格数据,依据升高温度对物质体积分数的影响效果判断温度高低,再利用甲烷与CO的平衡体积分数相等计算出转化的甲烷的物质的量,列出三段式,根据平衡常数的表达式计算解答;
(3)依据表格数据,选择合成CO和氢气量最多的物质作为载体;
(4)根据温度和压强对平衡的影响,结合平衡状态的特征回答;
(5)结合表格中三组数值,列出三个方程,解方程组即可求出n的值;再列出三段式,分别求出c(CO)与c(H2)的值,带入通式求得v正。
(1)①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
①-②可得到CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),则根据盖斯定律可知△H=+205.9 kJ·mol-1-(-41.2 kJ·mol-1)= +247.1 kJ·mol-1,因此该反应为吸热反应,要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为升高温度,
2CO(g)+2H2(g),则根据盖斯定律可知△H=+205.9 kJ·mol-1-(-41.2 kJ·mol-1)= +247.1 kJ·mol-1,因此该反应为吸热反应,要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为升高温度,
故答案为:+247.1;升高温度;
(2)同一个物质在不同的温度下所占的体积分数不同,因CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.1 kJ·mol-1,该反应为吸热反应,则升高温度则有利用平衡向正反应方向移动,导致CH4的体积分数降低,CO的体积分数升高。已知b>a>c,根据图表信息可知,T1<T2;T1下该反应的CH4与CO的体积分数均为a,则设CH4转化浓度为x mol/L,
2CO(g)+2H2(g) △H=+247.1 kJ·mol-1,该反应为吸热反应,则升高温度则有利用平衡向正反应方向移动,导致CH4的体积分数降低,CO的体积分数升高。已知b>a>c,根据图表信息可知,T1<T2;T1下该反应的CH4与CO的体积分数均为a,则设CH4转化浓度为x mol/L,

则根据T1下该反应的CH4与CO的体积分数均为a易知,![]() ,解得x=
,解得x=![]() ,所以平衡常数
,所以平衡常数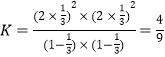 ,
,
故答案为:<;![]() ;
;
(3)从表中可以看出,MgO的原料转化率较高,且合成气的产率较高,所以选择MgO作为载体,
故答案为:MgO;此条件下合成气产率高;
(4)由于不能确定容器Ⅱ中二氧化碳的体积分数是否达到最小值,因此不能确定Ⅱ是否达到平衡状态,若未达平衡,压强越高反应逆向移动,相同时间内二氧化碳的含量越高,p3时,二氧化碳Ⅲ的含量比Ⅱ高,故Ⅲ到达平衡,
故答案为:III;
(5)组别1中c(CO)=0.24mol/L,c(H2) =0.48 mol/L,初始速率v正=0.361 mol/(L·min);则依据ν正=k正cm(CO)·cn(H2)可知,①0.361 mol/(L·min)=k正×(0.24 mol/L)m×(0.48 mol/L)n;同理,根据表格数据可得②0.720 mol/(L·min)=k正×(0.24 mol/L)m×(0.96 mol/L)n;③0.719 mol/(L·min)=k正×(0.48 mol/L)m×(0.48 mol/L)n;则②/①可得2=2n,即n=1;③/①得2=2m,则m=1;带入①得k正=3.134 L /min·mol。若该温度下平衡CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),组别1的产率为25%,设转化的CH4的物质的量浓度为y mol/L,则
2CO(g)+2H2(g),组别1的产率为25%,设转化的CH4的物质的量浓度为y mol/L,则

则![]() ,则y=0.12,则c(CO)=2y=0.24mol/L,c(H2) =2y=0.24 mol/L,k正是与温度有关的速率常数,保持不变,则依据给定公式可得ν正=k正c(CO)·c(H2)= 3.134 L /min·mol×0.24mol/L×0.24mol/L=0.180
,则y=0.12,则c(CO)=2y=0.24mol/L,c(H2) =2y=0.24 mol/L,k正是与温度有关的速率常数,保持不变,则依据给定公式可得ν正=k正c(CO)·c(H2)= 3.134 L /min·mol×0.24mol/L×0.24mol/L=0.180![]() 0.2 mol/(L·min),
0.2 mol/(L·min),
故答案为:1;0.2mol/(L·min)。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下水的离子积为______。
(2)该温度下0.01 mol/L NaOH溶液的pH为____。
(3)该温度下,将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,混合溶液呈中性,则Va﹕Vb=_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2mol CO和4mol H2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2mol CO和4mol H2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ·mol1
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= 43kJ·mol1
Ⅲ:CaO(s)+CO2(g)=CaCO3(s) △H= 178.3kJ·mol1
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ·mol1;若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=_____(用K1、K2、K3表示)。
CaCO3(s)+2H2(g)的△H=_______kJ·mol1;若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=_____(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是

A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸D(β-苯基丙烯酸)用于制备化妆品、香皂的香精,乜可制造局部麻醉剂、杀菌剂、止血药、植物生长促进剂、防腐剂、感光树脂等。下列是肉桂酸D的合成与应用的反应路线:
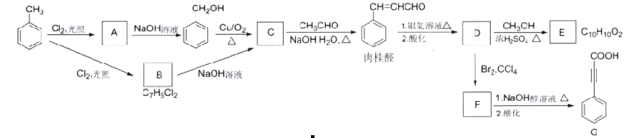
已知:![]()
(1)A的分子式是_______,A生成苯甲醇的反应类型是________。
(2)C的结构简式是_______,肉柱醛中的官能团名称是________。
(3)E是一种合成香精的定香剂,已知E为反式结构,则其结构简式为_______。
(4)在G中共直线的原子共有_______个,1molB转化为C最多消耗_______mol NaOH
(5)写出上图中F与NaOH醇溶液共热时的化学方程式________。
(6)P是E的同分异构体,写出符合下列条件的P的键线式_______。
①有两个相同的官能团;②能与新制氢氧化铜悬浊液作用产生砖红色沉淀;③含有苯环,核磁共振氢谱有三组面积之比为2︰2︰1的峰。
(7)以乙醇为原料,设计制备高分子化合物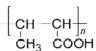 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 标准状况下,18g水的体积约为 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子数为3NA
C. NA个一氧化碳分子和 0.5mol 甲烷的质量比为 7∶4
D. 同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,16g O2含有的原子数为1 NA
C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L
D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com