
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
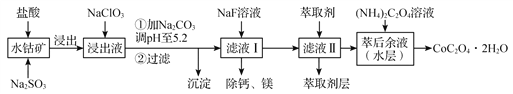
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将还原_________(填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:___________________________________________。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=______________________。【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(4)已知:NH3·H2O![]()
![]() +OH Kb=1.8×105;
+OH Kb=1.8×105;
H2C2O4![]() H++
H++![]() Ka1=5.4×102;
Ka1=5.4×102;
![]() H++
H++![]() Ka2=5.4×105。
Ka2=5.4×105。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施(其他条件一定)不能增大反应速率的是( )
A.增大HCl溶液的浓度B.粉碎CaCO3固体
C.升高反应体系的温度D.减小反应体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了实验方案来检验生成的气体是否为乙烯,实验装置如下图所示。
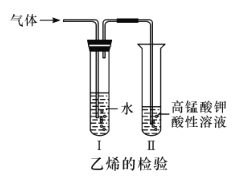
(1)试管I中水的作用是_________,如果不用试管I,对实验产生的影响是___________。
(2)试管II中还可用________(填一种试剂名称),若用此物质,是否能去掉试管I (填“能”或“不能”),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列电离方程式判断,下列分组正确的是( )
①H2SO4===2H++![]() 、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2
、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2![]() 、④NaHSO4===Na++H++
、④NaHSO4===Na++H++![]()
A. 属于酸的是①④ B. 属于碱的是②
C. 属于盐的只有③ D. 属于盐的只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A. 混合气体中含NO21.12 L B. 消耗氧气的体积为1.68 L
C. 此反应过程中转移的电子为0.3 mol D. 参加反应的硝酸是0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A. 右边CO与CO2分子数之比为3:1
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为6: 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是
A. 苏打 —— Na2CO3 B. 生石灰 —— Ca(OH)2
C. 胆矾 —— CuSO4 D. 生石膏 —— CaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com