
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
【答案】b FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl 光亮的“通路” a Fe(OH)3(胶体)+3HCl =FeCl3+3H2O
Fe(OH)3(胶体)+3HCl 光亮的“通路” a Fe(OH)3(胶体)+3HCl =FeCl3+3H2O
【解析】
(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液;
(2)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
(3)胶体具有丁达尔性质,是区别其它分散系的独特性质;
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是分散质粒子直径大小不同。
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,生成FeCl3溶液,变为黄色溶液。
(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故合理选项是b;
(2)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故制备Fe(OH)3胶体的化学反应方程式:FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(3)胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,是区别其它分散系的独特性质,当让一束光线通过制得的Fe(OH)3胶体,从侧面观察到一条光亮的“通路”;
(4) Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是分散质粒子直径大小不同,故合理选项是a;
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,生成FeCl3溶液,变为黄色溶液,发生反应的方程式为:Fe(OH)3(胶体)+3HCl =FeCl3+3H2O。


科目:高中化学 来源: 题型:
【题目】商代炼铜时,所用的矿物原料主要是孔雀石,主要燃料是木炭,在温度1000℃左右冶炼,可能涉及的反应有:
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O;②2CuO+C
2CuO+CO2↑+H2O;②2CuO+C![]() 2Cu+CO2↑;③CuO+CO
2Cu+CO2↑;③CuO+CO![]() Cu+CO2;④CO2+C
Cu+CO2;④CO2+C![]() 2CO。
2CO。
(1)从四种基本反应类型来看,①②④的反应类型分别为①____,②___,④____。
(2)从氧化还原反应的角度看,属于氧化还原反应的有_____。
(3)反应③中,___发生氧化反应,____发生还原反应。
(4)请在如图中用阴影部分表示反应③所属的区域。____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是
A. 1.0molCH4与3.0molCl2光照下反应生成的CHCl3分子数为1.0NA
B. 1.0mol·L-1的(NH4)3PO4溶液中阳离子数为3.0NA
C. 5.6gFe与过量浓盐酸完全反应转移的电子数为0.2NA
D. 常温下2.24LSO3中含有的质子数为4.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以香兰醛(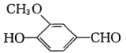 )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下:
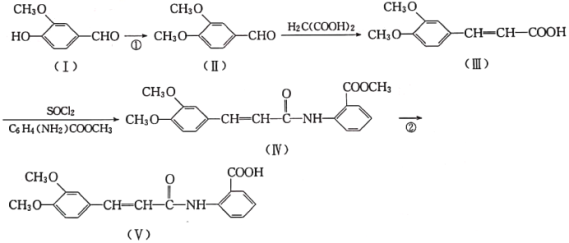
已知:![]() (酰胺键)在无肽键酶作用下的水解可忽略。
(酰胺键)在无肽键酶作用下的水解可忽略。
(1)H2C(COOH)2的化学名称为___________。
(2)①的反应类型是___________。
(3)反应②所需试剂条件分别为___________、___________。
(4)利喘贝(V)的分子式为___________。
(5)Ⅲ中官能团的名称是______________________。
(6)写出与香兰醛互为同分异构体的酯类化合物的结构简式(且核磁共振氢谱为四组峰,峰面积之比为1:2:2:3):____________________________________________(写出3种)。
(7)已知:![]() ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(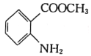 )的合成路线(其他无机试剂任选):__________________________________________________________________。
)的合成路线(其他无机试剂任选):__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:

已知:①Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4![]() 10-11
10-11
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mgL-1。残液中残留的Ca2+浓度至少应为_____mgL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
C. 在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆
D. 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法错误的是
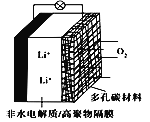
A. 放电时,多孔碳材料电极为正极
B. 放电时,外电路电子由锂电极流向多孔碳材料电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-0.5 x)O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com