
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
分析 (1)由表可知,60s时c(NO2)不再变化,反应达到平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率,60s后反应达平衡,反应混合物各组分的浓度不变;
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);根据v=$\frac{△c}{△t}$计算v(N2O4);
(3)根据60S时,反应达到平衡状态,根据平衡常数k=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(4)恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.1mol/L;
(5)若在相同情况下向该容器中充入0.2mol四氧化二氮和0.3mol二氧化氮气体,计算浓度幂之积,与平衡常数相比较,可判断反应进行的方向.
解答 解:(1)图标数据分析可知反应的化学方程式为:N2O4?2 NO2,
由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N2O4的转化率为$\frac{0.06mol/L}{0.1mol/L}$×100%=60%;
40S时平衡右移,c2>c3,
故答案为:60%;>;
(2)由表可知,20s时,c(NO2 )=0.060mol/L,所以
N2O4?2NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=$\frac{0.03mol/L}{20S}$=0.0015mol•(L•s)-1.
故答案为:0.070;0.0015;
(3)N2O4?2NO2,
起始(mol/L) 0.100 0
变化(mol/L) 0.060 0.120
平衡(mol/L) 0.040 0.120
平衡常数k=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{(0.12mol/L)^{2}}{0.040mol/L}$=0.36mol/L,
故答案为:0.36mol/L;
(4)恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.100mol/L,由N2O4(g)?2NO2(g)可知,二氧化氮的初始浓度=2×0.100mol/L=0.200mol/L,
故答案为:0.200;
(5)若在相同情况下向该容器中充入0.2mol四氧化二氮和0.3mol二氧化氮气体,则c(N2O4)=0.1mol/L,c(NO2)=0.15mol/L,$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.1{5}^{2}}{0.1}$=0.225<0.36,平衡正向移动,则正反应速率大于逆反应速率,
故答案为:>.
点评 本题考查化学平衡的有关计算应用,为高频考点,侧重考查学生的分析能力和计算能力,题目主要涉及平衡转化率、反应速率概念的计算应用,难度中等.


科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.84 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
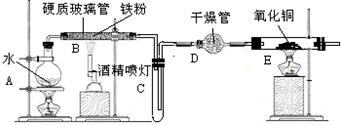
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
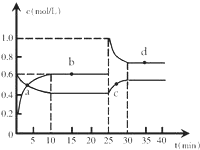 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
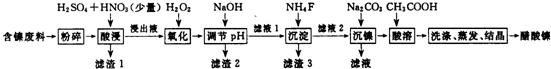
| 表1 | 表2 | |||
| 物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
| Ni2+ | 6.7 | 9.5 | NiCO3 | KSP=9.60×10-6 |
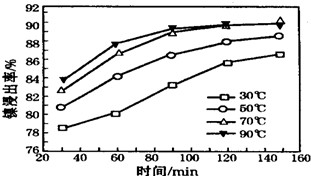
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量Na固体,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com