
【题目】下列属于电解质的是( )
A.稀盐酸B.蔗糖C.硫酸铜D.漂白粉
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH都相同
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为-241.8kJ/mol
C. 在稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量为57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1溴丁烷的反应如下:NaBr+H2SO4=HBr+NaHSO4①;R—OH+HBr→R—Br+H2O②。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
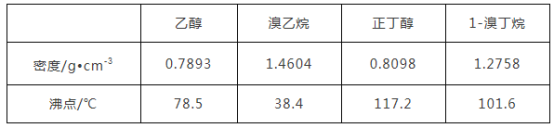
请回答下列问题:
(1)在溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)溴代烃的水溶性____(填“大于”“等于”或“小于”)相应的醇,其原因是________________。
(3)将1溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
A.NaI B.NaOH C.NaHSO3 D.KCl
(6)在制备溴乙烷时,采用边反应边蒸馏产物的方法,其有利于________;但在制备1溴丁烷时却不能边反应边蒸馏,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
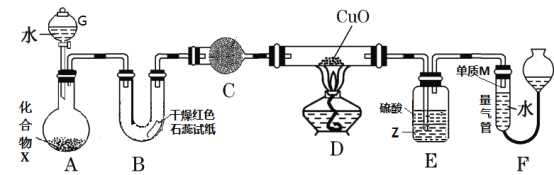
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中金属元素和非金属元素质量比为69:14,写出X与水反应的化学方程式:_________________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D
中固体颜色发生变化)________________________________________ 。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:_________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com