
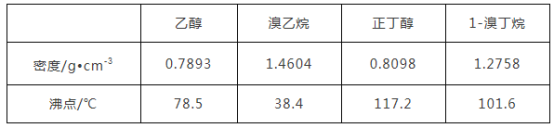
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1溴丁烷的反应如下:NaBr+H2SO4=HBr+NaHSO4①;R—OH+HBr→R—Br+H2O②。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
请回答下列问题:
(1)在溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)溴代烃的水溶性____(填“大于”“等于”或“小于”)相应的醇,其原因是________________。
(3)将1溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
A.NaI B.NaOH C.NaHSO3 D.KCl
(6)在制备溴乙烷时,采用边反应边蒸馏产物的方法,其有利于________;但在制备1溴丁烷时却不能边反应边蒸馏,其原因是______________________。
【答案】 D 小于 醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键 下层 ABC C 平衡向生成溴乙烷的方向移动(或反应②向右移动) 1溴丁烷与正丁醇的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出
【解析】(1)在溴乙烷和1-溴丁烷的制备实验中,最不可能用到的是漏斗;
(2)醇能和水形成氢键而易溶于水;
(3)1-溴丁烷的密度大于水,且和水不互溶;
(4)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解放热,溶液温度升高易使溴化氢挥发;
(4)根据题给信息知,1-溴丁烷和正丁醇的沸点相差较小,不能采用蒸馏的方法分离;
(5)根据溴代烷在碱溶液中水解,碘化钠和溴单质反应生成碘单质,氯化钠不能除去溴单质进行判断;
(6)根据平衡移动原理分析采用边反应边蒸出产物的原因;根据1-溴丁烷和正丁醇的沸点的大小判断。
(1)漏斗主要用于过滤操作,即有晶体析出时,但溴乙烷和一溴丁烷均不是晶体,则无需使用,答案为D;
(2)醇是能和水形成氢键的物质而易溶于水,溴代烃和水不反应也不能和水形成氢键,所以溴代烃的水溶性小于相应的醇;
(3)1-溴丁烷和水不能形成氢键所以不易溶于水,且密度大于水,因此将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层;
(4)A.浓硫酸和1-丁醇反应发生副反应消去反应生成烯烃、分子间脱水反应生成醚,稀释后不能发生类似反应减少副产物烯和醚的生成,A正确;
B.浓硫酸具有强氧化性能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成,B正确;
C.反应需要溴化氢和1-丁醇反应,浓硫酸溶解放热,溶液温度升高,使溴化氢挥发,稀释后减少HBr的挥发,C正确;
D.水是产物不是反应的催化剂,D错误;
答案选选ABC;
(5)欲除去溴代烷中的少量杂质Br2,则
A.NaI和溴单质反应,但生成的碘单质会混入,A错误;
B.溴单质和氢氧化钠反应,溴代烷也在NaOH溶液中水解反应,B错误;
C.溴单质和NaHSO3溶液发生氧化还原反应,可以除去溴单质,C正确;
D.KCl不能除去溴单质,D错误;
答案为C;
(6)根据题给信息知,乙醇和溴乙烷的沸点相差较大,采用边反应边蒸出产物的方法,可以使平衡向生成溴乙烷的方向移动,而1-溴丁烷和正丁醇的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出,所以不能边反应边蒸出产物。


科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③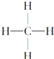 ④
④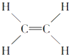 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,与14 g氢气的体积相等的氮气的( )
A. 质量为14 g
B. 物质的量为7 mol
C. 体积为22.4 L
D. 物质的量为14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③____________________________。
(3) 若pH过高,则对产品的影响是_________________________。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com