
【题目】等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )
A.NaOH溶液B.H2SO4稀溶液C.蔗糖溶液D.NaCl溶液
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W、X、Y、Z原子的最外层电子数之和为21,下列说法中不正确的是

A. 原子半径:X>Y>W
B. 简单阴离子的还原性:Z>W
C. 气态氢化物的稳定性:W>Y
D. 氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )
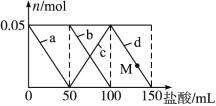
A. a曲线表示的离子方程式为:AlO2-+H++H2O ==Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9 g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定.
(3)二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
a.CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
①反应a在__________ (填“低温”或“高温”)下易自发进行。
②写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为__________________________________________________。
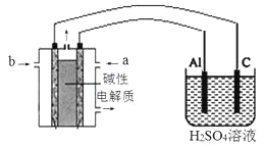
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C 的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题.(题中的字母只代表元素代号,与实际元素符号无关):
(1)B的元素符号为_________,E在元素周期表中的位置为__________;
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,请写出该反应的化学方程式___________。
(3)A2C和A2E两种物质沸点较高的是_______(填写化学式)。
(4)B与F两种元素形成的一种化合物分子,各原子均达8 电子结构,则该化合物化学式为____。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1溴丁烷的反应如下:NaBr+H2SO4=HBr+NaHSO4①;R—OH+HBr→R—Br+H2O②。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
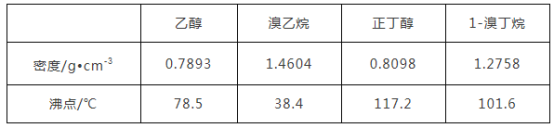
请回答下列问题:
(1)在溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)溴代烃的水溶性____(填“大于”“等于”或“小于”)相应的醇,其原因是________________。
(3)将1溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
A.NaI B.NaOH C.NaHSO3 D.KCl
(6)在制备溴乙烷时,采用边反应边蒸馏产物的方法,其有利于________;但在制备1溴丁烷时却不能边反应边蒸馏,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:
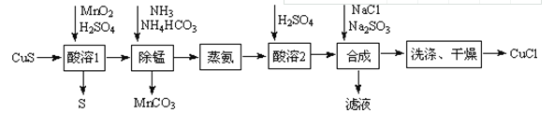
(1)酸溶1步骤中加入MnO2的作用是______。
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为______。溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是______。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是______。
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为_____。
(6)洗涤步骤先用______洗,再用无水乙醇洗涤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com