
(6分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发
如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+该反应常用于检验Mn2+的存在。其特征现象是___________。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
(1) 溶液由无色变为紫色 0.25 (2) Cl2
(3)①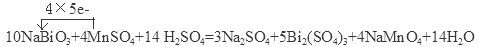 ②Bi2(SO4)3
②Bi2(SO4)3
【解析】
试题分析:在反应前Mn2+是无色的,反应后产生的MnO4-是紫色的,所以检验Mn2+的存在的特征现象是溶液由无色变为紫色;若反应中有0.1 mol还原剂Mn2+参加反应,失去电子0.5mol,根据反应过程中电子转移的物质的量相等可知:消耗氧化剂物质的量是0.5mol÷2=0.25mol;(2)若该反应所用的硫酸锰改为氯化锰,由于Cl-有还原性,会被氧化为氯气,所以当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有氯气;(3)①将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生反应方程式是: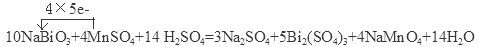 ②在上述反应中氧化剂NaBiO3产生的Bi2(SO4)3是还原产物。
②在上述反应中氧化剂NaBiO3产生的Bi2(SO4)3是还原产物。
考点:考查离子存在的检验方法、氧化还原反应方程式的配平、电子转移、及有关概念的判断的知识。


科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
碱金属及其化合物在生活和化工生产中具有广泛的用途,下列说法正确的是
A.钠钾合金能用作原子反应堆的导热剂是由于二者是活泼金属易失电子
B.用饱和碳酸氢钠制造灭火剂比用饱和碳酸钠制造灭火剂的效果好
C.碳酸钠可用于制造洗涤剂,因为碳酸钠是碱
D.五彩缤纷的焰火是K单质燃烧所致
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:选择题
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4
2H2SO4
B.热的纯碱溶液可以清洗油污的原因:CO32— +2H2O H2CO3+2OH?
H2CO3+2OH?
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH?=SiO32—+H2O
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法正确是( )
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO > NaClO4 D.酸性(水溶液):H2CO3 > HSCN > HCN
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:计算题
(7分)将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2多少克?(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________。
②若只能加入0.10 mol某物质,则加入的物质可以是________或________。
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)<M(乙),则气体的压强:甲>乙
C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
D.若M(甲)<M(乙),则的分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
下列离子或分子组中能大量共存,且满足相应要求的是 ( )
选项 | 离子或分子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Fe3+、NO | 滴加盐酸立即有气体产生 |
C | NH | 滴加NaOH溶液立即有气体产生 |
D | Na+、HCO | 滴加氨水立即有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
关于胶体的认识以及应用不正确的是
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化
B.纳米材料微粒直径一般从几纳米到几十纳米(1 nm= 10?9 m).因此纳米材料属于胶体
C.往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解
D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
阿伏加德罗常数的值为6.02×1023mol-1,下列叙述中错误的是:
①12.4g 白磷晶体中含有的P-P键数是0.6×6.02×1023
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0. 1×6.02×1023
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1mol O2在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数等于2×6.02×1023
⑤2.9g 2CaSO4?H2O含有的结晶水分子数为0.02×6.02×1023
A.①②③④⑤ B. ①③④⑤ C. ②③④⑤ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com