
(7分)将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2多少克?(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________。
②若只能加入0.10 mol某物质,则加入的物质可以是________或________。
(1)4.4;(2)①Na2O Na2O2 ②Na NaOH(或NaH)
【解析】
试题分析:n(CO2)=4.48L÷22.4L/mol=0.2mol;若完全转化为Na2CO3,其质量是m(Na2CO3)= 0.2mol×106g/mol =21.2g,若完全转化为NaHCO3,其质量是m(NaHCO3)= 0.2mol×84g/mol=16.8g,现在质量是19.0 g,介于二者之间,所以得到的是Na2CO3、NaHCO3的混合物。假设混合物中Na2CO3、NaHCO3的物质的量分别是x、y,则根据C守恒可得x+y=0.2,根据质量守恒定律可得106x+84y=19.0,解得x=0.1mol,y=0.1mol;(1)Na2CO3 + H2O + CO2=2NaHCO3 △m(增重)
1 mol 44 g 62 g
0.1 mol 4.4 g 25.2 g-19.0 g=6.2g
可见若再通入4.4 g CO2恰好使0.1 mol Na2CO3全变为NaHCO3,得到的固体的质量就是25.2 g,符合题意(2)依题意可知在19.0g固体中含有0.1 mol Na2CO3、0.1 mol NaHCO3 。21.2 g Na2CO3的物质的量 是21.2g÷106g/mol=0.2mol,若加入某物质使0.1 mol NaHCO3变为0.1 mol Na2CO3,“某种物质”需满足3个条件:一是显碱性或能生成碱,二是需加入Na元素,三是不能带来其它杂质。而①中据Na守恒0.05 mol物质中需有0.1 mol Na,故符合条件的只有Na2O或Na2O2,②中据Na守恒0.1 mol物质中需有0.1 mol Na,故符合条件的可有Na、NaOH、NaH。
考点:考查钠元素的单质及化合物的相互转化关系及有关计算的知识。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
2009年10月1日,在天安门广场举行了隆重的国庆阅兵仪式,展现了我国强大的综合国力,其中坦克的展示无疑是一个巨大的亮点。坦克的制造材料主要是各种金属的合金,钢铁便是其中十分重要的一种。下列关于铁的说法中,正确的是
A.铁元素属于过渡元素,其原子序数为26
B.单质铁与浓硫酸在常温下不反应
C.铁单质只具有还原性,其阳离子只具有氧化性
D.与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:填空题
(14分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
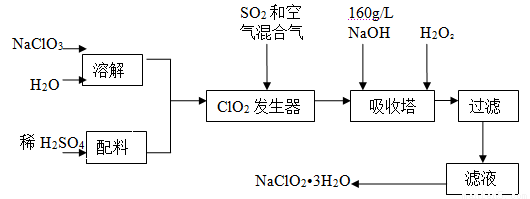
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1) 160 g/L NaOH溶液的物质的量浓度为 。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6) 从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a蒸馏 b蒸发 c灼烧 d过滤 e冷却结晶
要得到更纯的NaClO2?3H2O晶体必须进行的操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
组成和结构可用
 表示的有机物中,能发生消去反应的共有
表示的有机物中,能发生消去反应的共有
A.10种 B.16种 C.20种 D.25种
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如右图所示。下列说法不正确的是( )

A.原子半径:Z>W>Y
B.Z和Y形成的化合物是离子化合物
C.气态氢化物的稳定性:R<Y
D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:填空题
(6分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发
如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+该反应常用于检验Mn2+的存在。其特征现象是___________。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯②电解质:明矾、冰醋酸、石膏、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 ;④同位素:1 H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨 ; ⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物
A.②⑤⑨ B.①②⑤⑦⑨ C.②⑤⑥⑦⑨ D.全部正确
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。请你据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。则下列选项正确的是
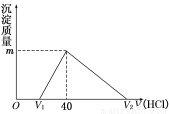
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中V2为60 mL D.图中m值为1.56 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com