
| A. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| B. | 氧化物:CO2、NO、SO2、H2O | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3 |
分析 A、水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱;
B、两种元素组成其中一种为氧元素的化合物为氧化物;
C、含铵根离子的盐为铵盐;
D、和酸反应生成盐和水的氧化物为碱性氧化物,反应为复分解反应.
解答 解:A、Na2CO3 属于盐,溶液显碱性是因为碳酸根离子水解,碳酸钠不是碱,故A错误;
B、CO2、NO、SO2、H2O符合氧化物概念,故B正确;
C、NH4Cl、NH4NO3、(NH4)2SO4属于铵盐,NH3•H2O属于弱碱不是盐,故C错误;
D、Na2O、CaO属于碱性氧化物,Al2O3 属于两性氧化物和酸、碱都反应生成盐和水,故D错误;
故选B.
点评 本题考查了物质分类的方法和概念实质理解应用,注意物质组成和概念的判断依据,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 它们的最高价氧化物对应的水化物中,Y(OH)m是一种两性氢氧化物,其碱性比X(OH)n弱,其酸性也比Z的最高价含氧酸弱 | |
| B. | 原子半径Z>X>Y | |
| C. | 单质的还原性Y>X | |
| D. | Xn+、Ym+、Zp-的半径:Xn+>Ym+>Zp- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
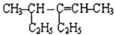 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯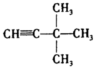 3,3-二甲基-1-丁炔.
3,3-二甲基-1-丁炔.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| B. | 由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3↓ | |
| C. | 由Al、Mg、稀硫酸组成的原电池,其负极反应式为:Al-3e-=Al3+ | |
| D. | 由Fe、Cu、FeCl3组成的原电池,其正极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
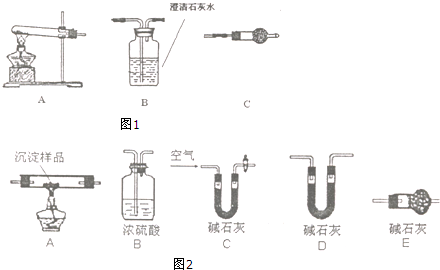
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
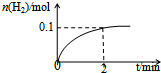 化学平衡:
化学平衡:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
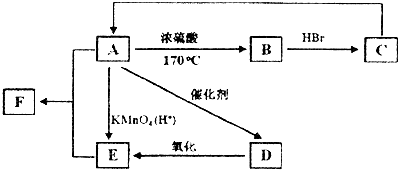
 ,
,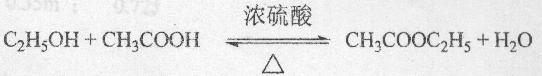 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 任何条件下,等物质的量的CO和NO所含的分子数一定相等 | |
| C. | 1L CO气体一定比1L O2的质量小 | |
| D. | 相同条件下的CO和N2,若体积相等,则质量一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com