
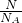 计算物质的量,分子物质的量为1mol,原子物质的量为2mol,说明是双原子分子;
计算物质的量,分子物质的量为1mol,原子物质的量为2mol,说明是双原子分子;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
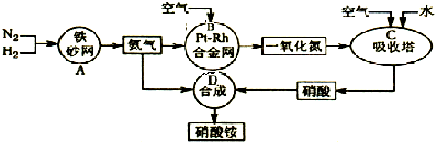
 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:

| ||
| ||
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
34 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol.则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol | B、已知C2H5OH(l) 的燃烧热是1366.8KJ/mol,则C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)反应的△H=-1366.8kJ/mol | C、一定条件下2SO2(g)+O2(g)?2SO3(g)△H1,2SO2(g)+O2(g)?2SO3(l)△H2则△H1>△H2 | D、在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com