
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-
B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl-
【答案】A
【解析】
第一份:第一份加入AgNO3,溶液有沉淀产生,说明溶液中可能存在:Cl、CO32、SO42;
第二份:加足量NaOH溶液加热后生成的0.08mol气体为氨气,则溶液中一定含有NH4+,且物质的量为0.08mol;
第三份:能够与氯化钡生成白色沉淀的为碳酸根离子或硫酸根离子,根据题中信息可知4.66g为硫酸钡,12.54g为硫酸钡和碳酸钡的混合物,因此一定不存在Mg2+、Ba2+。![]() ,碳酸钡的物质的量为:
,碳酸钡的物质的量为:![]() ;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.08mol;负电荷:n(-)=2n(CO32)+2n(SO42)=0.12mol,故一定有K+,至少0.04mol;根据以上分析可知,溶液中一定存在:K+、NH4+、CO32、SO42,可能含有Cl,若存在氯离子,钾离子的物质的量大于0.04mol;若不存在氯离子,钾离子的物质的量为0.04mol,所以A正确。故答案选:A。
;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.08mol;负电荷:n(-)=2n(CO32)+2n(SO42)=0.12mol,故一定有K+,至少0.04mol;根据以上分析可知,溶液中一定存在:K+、NH4+、CO32、SO42,可能含有Cl,若存在氯离子,钾离子的物质的量大于0.04mol;若不存在氯离子,钾离子的物质的量为0.04mol,所以A正确。故答案选:A。


科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,该药物通常以 2-氯苯甲醛为原料合成,合成路线如下:
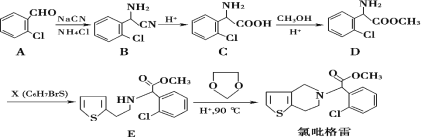
(1)下列关于氯吡格雷的说法正确的是__________。
A.氯吡格雷在一定条件下能发生消去反应
B.氯吡格雷难溶于水,在一定条件下能发生水解反应
C.1mol氯吡格雷含有5NA个碳碳双键,一定条件下最多能与5molH2发生加成反应
D.氯吡格雷的分子式为C16H16ClNO2S
(2)物质 D 的核磁共振氢谱有_________种吸收峰。
(3)物质 X 的结构简式为____________。
(4)物质 C可在一定条件下反应生成一种含有 3个六元环的产物,写出该反应的化学方程式______,反应类型是__________。
(5)写出属于芳香族化合物 A的同分异构体__________(不包含 A)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
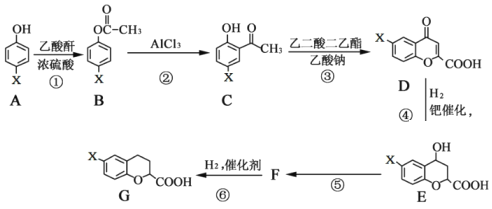
已知:乙酸酐的结构简式为 ![]() 请回答下列问题:
请回答下列问题:
(1)G物质中的含氧官能团的名称是_________________。
(2)乙二酸二乙酯的结构简式为__________________。
(3)反应A→B的化学方程式为__________________。
(4)上述⑤变化过程的反应类型为_________。
(5)有机物F的结构简式为_________。
(6)写出满足下列条件的C的同分异构体有_______种。
Ⅰ. X取代基连接在苯环上; Ⅱ. 能与NaHCO3反应生成CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的锌与100mL18.5molL﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1molL﹣1.则生成的气体中SO2和H2的体积比为( )
A.1:2B.2:1C.1:4D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的( )
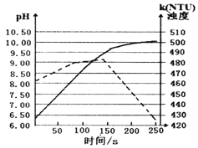
A.该实验是在常温下进行的
B.实线表示溶液浊度随时间的变化
C.50s时向溶液中滴入酚酞试液,溶液变红
D.该反应温度下饱和Mg(OH)2溶液的pH约为10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.配制酸性KMnO4标准溶液:下图是配制50 mL酸性KMnO4标准溶液的过程示意图。
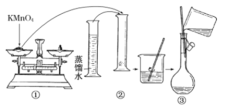
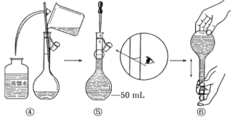
(1)请你观察图示并判断其中不正确的操作有______________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________________(填名称)。
(3)如果按照图示的操作配制溶液,在其他操作均正确的情况下,配制溶液的浓度将______(填“偏大”或“偏小”)。
II.测定血液样品中Ca2+的浓度:取血液样品20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1酸性 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)请写出草酸与酸性KMnO4溶液反应的离子方程式 ____________________________。
(5)滴定时,根据现象_________________________,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为______________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为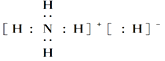
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成![]() ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
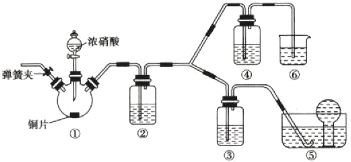
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与![]() 反应:
反应:![]() 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________。
(3)装置①中发生反应的化学方程式是____________________________________________。
(4)装置②的作用是_____________________,发生反应的化学方程式是________________________________________。
(5)该小组得出的结论所依据的实验现象是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇具有紫丁香味,其酯类常用于香精调制。下图为松油醇的结构,以下关于它的说法正确的是
![]()
A. 分子式为C10H19O
B. 同分异构体可能属于醛类、酮类或酚类
C. 与氢气加成后的产物有4种一氯代物
D. 能发生取代、氧化、还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com