
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:
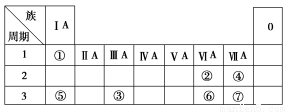
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
(1)Na>Cl>F
(2)HClO4 H2SO4
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
②取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成
③0.01
④Al(OH)3、H2O、NaCl
【解析】根据元素在周期表中的位置可以确定各元素。
(1)由元素周期表中原子半径递变规律可知,原子半径Na>Cl>F。
(2)非金属性S<Cl,故酸性H2SO4<HClO4。
(3)H、O按1∶1组成H2O2,可氧化Fe2+:H2O2+2Fe2++2H+=2Fe3++2H2O
(4)黄绿色气体B为Cl2,由图中转化关系可知A为NaCl,C为H2,D为NaOH,由D(NaOH)可以和G反应生成C(H2)可知,G为Al。
①2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
②检验Cl-应取少量试液,滴加硝酸酸化的硝酸银溶液。
③2NaCl+2H2O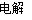 2NaOH+H2↑+Cl2↑,产生OH-的物质的量为:0.01 mol/L×1 L=0.01 mol,每生成1 mol NaOH转移1 mol电子。故转移电子为0.01 mol。
2NaOH+H2↑+Cl2↑,产生OH-的物质的量为:0.01 mol/L×1 L=0.01 mol,每生成1 mol NaOH转移1 mol电子。故转移电子为0.01 mol。
④由各步反应恰好完全转化可知HCl和NaAlO2溶液等物质的量混合,发生反应:HCl+NaAlO2+H2O=Al(OH)3↓+NaCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:选择题
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
ABCD
强电解质FeNaClCaCO3HNO3
弱电解质CH3COOHNH3H3PO4Fe(OH)3
非电解质C12H22O11
(蔗糖)BaSO4C2H5OHH2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-1练习卷(解析版) 题型:选择题
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应
速率最快的是( )
A.v(CO)=1.5 mol·L-1·min-1
B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1
D.v(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原
子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:选择题
下列关于元素的叙述正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.由非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-2练习卷(解析版) 题型:选择题
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )
元素代号 | L | M | Q | R | T |
原子半径 | 0.160 nm | 0.143 nm | 0.112 nm | 0.104 nm | 0.066 nm |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-2练习卷(解析版) 题型:选择题
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
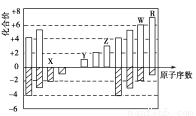
A.原子半径:Z>Y>X
B.气态氢化物的稳定性R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-4练习卷(解析版) 题型:选择题
将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是 ,可能有的阳离子是 。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是 ,可能含有的阳离子是 。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为 。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-1练习卷(解析版) 题型:填空题
氮化硅可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如下图所示:
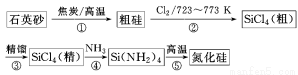
其中-NH2中各元素的化合价与NH3相同。请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学反应方程式表示其原因: 。
(2)图示①~⑤的变化中,属于氧化还原反应的是 。(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学反应方程式为 。
(4)在反应⑤中,3 mol Si(NH2)4,在高温下加热可得1 mol氮化硅粉末和8 mol A气体,则氮化硅的化学式为 。
(5)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com