
【题目】下列说法或表示方法正确的是
A.凡是放热反应,不需加热即可发生
B.由“C(石墨)=C(金刚石)△H =+1.9kJ/mol”可知,金刚石比石墨稳定
C.在l0lkPa时,2gH2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴:△H =-285.8kJ/mol。
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H =-57.3kJ/mol,若将含 lmolCH3COOH 与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ
【答案】D
【解析】
A.反应是放热反应表明反应物的能量比生成物的能量高,反应发生时多余的能量以热能的形式释放出来,与反应是否需要加热无关,A错误;
B.石墨转化为金刚石时吸收热量,说明石墨含有的能量低,石墨比金刚石稳定,B错误;
C.2gH2的物质的量是1mol,在l0lkPa时,2gH2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+![]() O2(g)=H2O(l),△H =-285.8kJ/mol,C错误;
O2(g)=H2O(l),△H =-285.8kJ/mol,C错误;
D.醋酸是弱电解质,电离产生H+时吸收热量,所以若将含lmolCH3COOH与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ,D正确;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
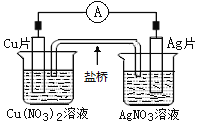
A.电子沿导线由Cu片流向Ag片
B.盐桥中的K+向Cu(NO3)2溶液
C.正极的电极反应是Ag++e-=Ag
D.Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaOH溶液来滴定邻苯二甲酸氢钾溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_____________________________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是______________。
(2)选用指示剂是______________,滴定终点现象______________________________________。
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是_______________。
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6 mol A气体和5 mol B气体混合充入4 L 密闭容器中,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
A. x=2B. B的转化率为20%
C. 平衡时A的浓度为0.75 mol·L-1D. 恒温达到平衡时容器内的压强为开始的75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.反应N2(g)+3H2(g)![]() 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
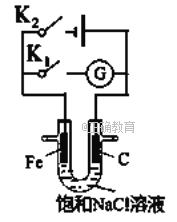
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:
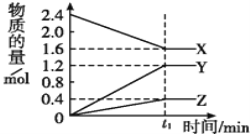
(1)该反应的化学方程式是_________。若t1=10min,用X表示化学反应速率为_________
(2)若上述反应中X,Y,Z分别为NH3、H2、N2, 且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;
(3)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”或“不变”)。化学平衡常数K_______ (填“增大”或“减小”或“不变”)
(4)在一定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________
②能判断该反应达到化学平衡状态的依据是_______
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__________℃;
(6)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L-1,c(H2)=1.5mol·L-1,c(CO)=1mol·L-1,c(H2O)=3mol·L-1,则下一时刻,反应向__________(填"正反应"或"逆反应")方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molCO和3molH2O混合于2L的密闭容器中,发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
(1)该化学反应的平衡常数表达式:___。
(2)已知在700℃时,该反应的平衡常数K1=2,则该温度下反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K2=__,反应2CO(g)+2H2O(g)2CO2(g)+2H2(g)的平衡常数K3=___。
(3)已知在1000℃时,该反应的平衡常数K4=1.0,则该反应为___反应(填“吸热”或“放热”),△H__0(填“>”或“<”)。
(4)在1000℃下,某时刻CO2的物质的量为1mol,则此时υ(正)__υ(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com