
【题目】下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.反应N2(g)+3H2(g)![]() 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以将温室气体CO2转化为燃料气体CO.下列说法中,正确的是( )
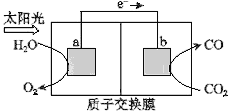
A.该装置工作时,H+从b极区向a极区移动
B.该装置中每生成1 mol CO,同时生成1 mol O2
C.电极a表面发生还原反应
D.该过程是将太阳能转化为化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来解释实验事实的相关平衡方程式不正确的是
实验事实 | 相关平衡 | |
A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O |
B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH- |
C | 溶有CO2的正常雨水pH≈5.6 | H2O+CO2 |
D | CaCO3固体溶于盐酸 | CaCO3(s) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.凡是放热反应,不需加热即可发生
B.由“C(石墨)=C(金刚石)△H =+1.9kJ/mol”可知,金刚石比石墨稳定
C.在l0lkPa时,2gH2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴:△H =-285.8kJ/mol。
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H =-57.3kJ/mol,若将含 lmolCH3COOH 与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和Cu2O,在水溶液中用H将CO2高效还原为重要工业原料之一的甲醇,其反应机理如图所示。则下列有关说法不正确的是( )
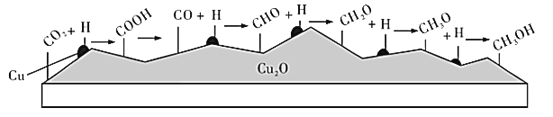
A.CO2生成甲醇是通过多步氧化反应实现的
B.该催化反应过程中涉及了化学键的形成及断裂
C.有可能通过调节控制反应条件获得甲醛等有机物
D.催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法错误的是
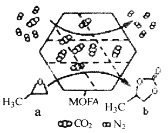
A.物质a分子中碳原子和氧原子均采取sp3杂化
B.b的一氯代物有3种
C.a生成b的反应类型为取代反应,并有极性共价键形成
D.该材料的吸附作用具有选择性,利用此法可减少CO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置加以必要的导线连接后达到粗铜精炼的目的。

⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中Zn接B烧杯中的___________,(填“粗铜”或“纯铜”),B烧杯中应该盛____________溶液。
⑶分别写出石墨棒和纯铜棒的电极反应式
石墨棒:____________________________________,
纯铜棒:____________________________________。
⑷若锌减少了0.65 g,则纯Cu的质量增加了________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com