
【题目】用下图装置加以必要的导线连接后达到粗铜精炼的目的。

⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中Zn接B烧杯中的___________,(填“粗铜”或“纯铜”),B烧杯中应该盛____________溶液。
⑶分别写出石墨棒和纯铜棒的电极反应式
石墨棒:____________________________________,
纯铜棒:____________________________________。
⑷若锌减少了0.65 g,则纯Cu的质量增加了________g。
【答案】原电池 原解池 纯铜 CuSO4或其它易溶性的铜盐 2H++2e-=H2↑ Cu2++2e-=Cu 0.64
【解析】
(1)根据原电池和电解池的构成条件来分析;
(2)电解精炼铜时,电解质溶液是含有铜离子的盐;
(3)根据电解池和原电池的工作原理来书写电极反应;
(4)根据电极反应和电子守恒来计算。
(1)A烧杯含有两个活泼性不同的电极,有自发的氧化还原反应,形成了闭合回路,存在电解质溶液,属于原电池装置,B烧杯就存在了外加电源,属于电解装置;
因此,本题正确答案是:原电池;电解池;
(2)电解精炼铜时,粗铜做阳极,与电源的正极相连,纯铜做阴极,与电源的负极相连;电解质溶液必须是含有铜离子的可溶性的盐,如硫酸铜溶液或其它易溶性的铜盐等;
因此,本题正确答案是: 纯铜;CuSO4或其它易溶性的铜盐;
(3)石墨棒是原电池的正极,发生电极反应为: 2H++2e-=H2↑;纯铜棒是电解池的阴极,
电极反应为: Cu2++2e-=Cu;
因此,本题正确答案是: 2H++2e-=H2↑;Cu2++2e-=Cu;
(4)在A烧杯中,金属锌电极发生的电极反应为:Zn-2e-=Zn,若锌减少了0.65 g即0.01mol时,转移电子为0.02mol,在B烧杯中,纯铜电极发生的反应为: Cu2++2e-=Cu,当转移0.02mol电子时,则析出金属Cu的物质的量为0.01mol,质量为0.64g;
因此,本题正确答案是:0.64。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.反应N2(g)+3H2(g)![]() 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数,下列说法正确的是( )
A.标准状况下,560mL的氢气和氯气的混合气体充分反应后共价键数目为0.05NA
B.标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
C.常温常压下,1.5molHCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
D.0.1mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molCO和3molH2O混合于2L的密闭容器中,发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
(1)该化学反应的平衡常数表达式:___。
(2)已知在700℃时,该反应的平衡常数K1=2,则该温度下反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K2=__,反应2CO(g)+2H2O(g)2CO2(g)+2H2(g)的平衡常数K3=___。
(3)已知在1000℃时,该反应的平衡常数K4=1.0,则该反应为___反应(填“吸热”或“放热”),△H__0(填“>”或“<”)。
(4)在1000℃下,某时刻CO2的物质的量为1mol,则此时υ(正)__υ(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如图:

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__。
(2)为提高水浸速率,可采取的措施为__(任写一条即可),“浸渣”的主要成分为___。
(3)①“调节pH除杂”时,除去的杂质离子是__,室温下,若要将溶液中的c(Fe3+)降低至4.0×10-11mol/L,则应控制溶液的pH=___(Ksp[Fe(OH)3]=4.0×10-38)。
②“调节pH除杂”时,可以选用的试剂是___。
A.MgO B.NaOH C.MgCO3 D.HNO3
(4)“沉镁”过程中反应的离子方程式为___。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁[Mg2(OH)2CO3]杂质,原因是__。
(5)某小组同学称取15.6gMgCO3·nH2O进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则n=__。
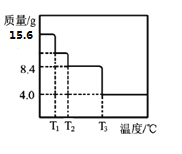
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100mol/LHCl溶液滴定0.100mol/LNa2CO3溶液的滴定曲线如图,已知f=![]() 。下列说法错误的是
。下列说法错误的是
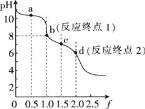
A.a点溶液中:c(HCO3-)>c(CO32-)
B.b点溶液中:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.溶液中水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。
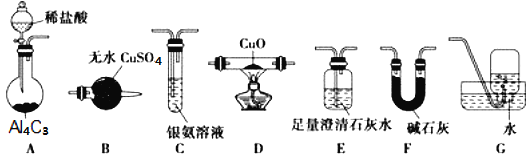
查阅资料:
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O
③已知Al4C3与CaC2类似易水解,CaC2的水解方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑
(1)装置A中反应的化学方程式为___。
(2)装置F的作用为___;装置B的名称为___。
(3)按气流方向各装置从左到右的连接顺序为A→__。(填装置名称对应字母,每个装置限用一次)
(4)实验中若将A中分液漏斗换成![]() (恒压漏斗)更好,其原因是___。
(恒压漏斗)更好,其原因是___。
(5)装置D中可能观察到的现象是___。
(6)当反应结束后,装置D处试管中固体全部变为红色。设计实验证明红色固体中含有Cu2O(简述操作过程及现象):__。
查看答案和解析>>
科目:高中化学 来源: 题型:
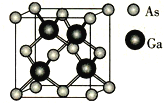
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]________,下列状态的铝中,电离最外层的一个电子所需能量最小的是_____________(填标号)。
A. ![]() B.
B. ![]() C.[Ne] D.
C.[Ne] D. ![]()
(2)8—羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与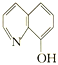 (8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;
(8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______; 所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是____________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_______;其中Al的配位数为_________。
(4)GaAs的晶胞结构如图所示,紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() =________。
=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com