
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,该药物合成路线通常以2-氯苯甲醛为原料的合成,合成路线如下:
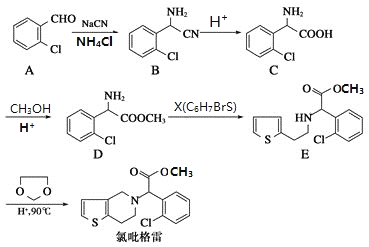
(1)下列关于氯吡格雷的说法正确的是___________。
A.氯吡格雷在一定条件下能发生消去反应
B.氯吡格雷难溶于水,在一定条件下能发生水解反应
C.lmol氯吡格雷含有5NA个碳碳双键,一定条件下最多能与5molH2发生加成反应
D.氯吡格雷的分子式为C16H16ClNO2S
(2)物质D的核磁共振氢谱有__________种吸收峰。
(3)物质X的结构简式为_____________。
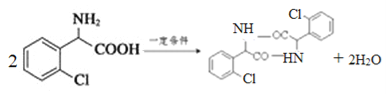
(4)物质C可在一定条件下反应生成一种含有3个六元环的产物,写出该反应的化学方程式__________,反应类型是______________。
(5)写出属于芳香族化合物A的同分异构体______________(不包含A )
(6)已知:![]() ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物![]() 的合成路线流程图__________________(无机试剂任选)。
的合成路线流程图__________________(无机试剂任选)。
【答案】 BD 7 ![]()
 取代
取代 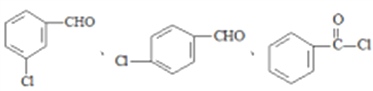
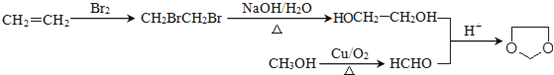
【解析】(1)A.苯环上的氯原子不能发生消去反应,A错误;B.氯吡格雷含有酯基、氯原子,难溶于水,在一定条件下能发生水解反应,B正确;C.苯环不含碳碳双键,lmol氯吡格雷含有2NA个碳碳双键,但苯环能发生加成反应,一定条件下最多能与5molH2发生加成反应,C错误;D.氯吡格雷的分子式为C16H16ClNO2S,D正确,答案选BD。(2)根据物质D的结构简式可知结构不对称,核磁共振氢谱有7种吸收峰。(3)根据D和E的结构简式可知D中氨基上的氢原子被溴原子取代,因此物质X的结构简式为![]() 。(4)物质C含有氨基和羧基,可在一定条件下发生取代反应生成一种含有3个六元环的产物,该反应的化学方程式为
。(4)物质C含有氨基和羧基,可在一定条件下发生取代反应生成一种含有3个六元环的产物,该反应的化学方程式为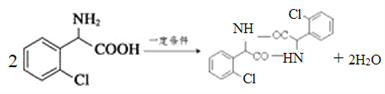 。(5)属于芳香族化合物A的同分异构体有
。(5)属于芳香族化合物A的同分异构体有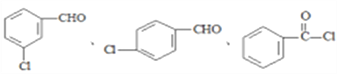 ;(6)乙烯与溴发生加成反应生成BrCH2CH2Br,再水解生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成
;(6)乙烯与溴发生加成反应生成BrCH2CH2Br,再水解生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成![]() ,合成路线流程图为
,合成路线流程图为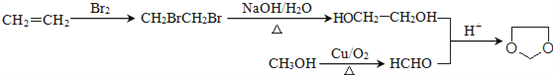 。
。


科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是

A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =4.2,则Ka2(H2A)的数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中一定正确的是
A. 1molFe与高温水蒸气反应,转移电子的数目为3NA
B. 标准状况下,2.24LHF中含有的极性键数目为0.1NA
C. 5mL0.1mol/LCH3COOH溶液和10mL0.5mol/LCH3COOH溶液中所含CH3COOH分子数相等
D. 一定条件下,向0.1L容器内通入4.6gNO2气体,NO2的物质的量浓度小于1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 若2.24L某气体中含有的分子数为0.1NA,则该气体所处的状态一定为标准状况
B. 一定条件下,密闭容器中1.4gN2与0.2molH2充分反应,转移的电子数为0.3NA
C. 0.1mol熔融状态下的NaHSO4中含有的阴离子数为0.2NA
D. 7.4g丁醇中存在的共价键总数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K2,断开K1,发现电流计指针发生偏转。下列说法不正确的是

A. 一段时间后电流计指针将归零,此时可视为反应不再进行
B. 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升
C. 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加
D. 实验开始先闭合K2,断开K1,此时NO3-向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量N2常利用的反应是NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A. NaNO2发生氧化反应
B. 生成1 mol N2时转移的电子数为6 mol
C. NH4Cl中的氮元素被还原
D. 被氧化和被还原的元素是同一种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H =-273kL/mol
②NO2-(aq)+l/2O2(g)=NO3-(aq) △H =-73kL/mol
下列叙述不正确的是
A. lmol的NH3和1mol的NH4+都有10×6.02×1023个电子
B. 室温下,0.1mol/LHNO2(aq) pH>l,则NaNO2溶液显碱性
C. NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H =-346kL/mol
D. 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式__________________________________________。
(2)比较下列溶液中指定微粒浓度的大小:浓度均为0.1 mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是_____________。(填序号)c(H2S)从大到小的顺序是__________。(填序号)
(3)已知Ksp[Cu(OH)2] = 1×10-20 。要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com