
����Ŀ������ԭ��ص������кܶ࣬����һ�־������õ���ʵ�Ũ�Ȳ�ɡ�Ũ���ء������������ij���ӵ�Ũ��Խ��ʱ�������Ի�ԭ��Խǿ����ͼ���׳�Ϊ3mol��L-1��AgNO3��Һ���ҳ�Ϊ1mol��L-1��AgNO3��Һ��A��B��ΪAg�缫��ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1�����ֵ�����ָ�뷢��ƫת������˵������ȷ����

A. һ��ʱ��������ָ�뽫���㣬��ʱ����Ϊ��Ӧ���ٽ���
B. ��������ָ�����պ�K1���Ͽ�K2���ҳ���ҺŨ������
C. ��������ָ�����պ�K1���Ͽ�K2������Ag�缫��������
D. ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1����ʱNO3-��B�缫�ƶ�
���𰸡�C
��������A. �պ�K2������Ũ���أ����ڼ׳���������Ũ�ȴ�������ǿ��������ԭ��Ӧ���׳�Ϊ�������ҳ�Ϊ�������׳�����������Ũ����С���ҳ�����������Ũ��������һ��ʱ���Ũ����ȣ����ٹ���Ũ���أ�������ָ�뽫���㣬��Ӧ���ٽ��У���A��ȷ��B. ��������ָ�����պ�K1���Ͽ�K2���ɵ��أ��ҳ�����Ϊ������������Ũ��������B��ȷ��C. ��������ָ�����պ�K1���Ͽ�K2���ɵ��أ��ҳ�����Ϊ���������缫���ܽ⣬������С����C����D. ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1������Ũ���أ����ڼ׳���������Ũ�ȴ�������ǿ��������ԭ��Ӧ���׳�Ϊ�������ҳ�Ϊ�������׳�����������Ũ����С���ҳ�����������Ũ��������ʱNO3-��B�缫�ƶ�����D��ȷ����ѡC��


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��֤����ˮ��������� �� ��
A. ��ˮ�ܸ��Ȼ�������Һ��Ӧ�������������� B. ��������ֽ�
C. 0.1mol/L��ˮ����ʹ��̪��Һ��� D. 0.1mol/L�Ȼ����Һ��pHΪ5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X�Ǻϳ�ijҩ����м��壬X�Ľṹ��ʽΪ�� ���л���AΪԭ�Ϻϳ�X��������ͼ��ʾ����������ʡ�ԣ���
���л���AΪԭ�Ϻϳ�X��������ͼ��ʾ����������ʡ�ԣ���

(1)����ٵķ�Ӧ����Ϊ____��
(2)D�����й����ŵ�������____ ��
(3)�������E�Ľṹ��ʽΪ_______��̼���Ƶ�������_________��
(4)1mol B��������H2�����ʵ���Ϊ______mol��
(5)���� ���Ʊ�ij���Խṹ�߷��ӷ�ȩ��֬���÷�Ӧ�Ļ�ѧ����ʽΪ____��
���Ʊ�ij���Խṹ�߷��ӷ�ȩ��֬���÷�Ӧ�Ļ�ѧ����ʽΪ____��
(6)������������![]() ��ͬ���칹����____�֡�
��ͬ���칹����____�֡�
�ٱ�����������ȡ������
���ܷ���������Ӧ��
������̼��������Һ��Ӧ�ų�������̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ������CO2��H2��һ�������·�Ӧ�ϳɼ״���
(1)��֪��
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H=-1275.6kJ��mol-1
��2CO(g)+O2(g)=2CO2(g) ��H=-566.0 kJ��mol-1
��H2O(g)=H2O(l) ��H=-44.0 kJ��mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ_______________________��
(2)���ݻ�Ϊ1L���ܱ������У�Ͷ��1molCO��2molH2���ڲ�ͬ�����·�����Ӧ��CO(g)+2H2(g) ![]() CH3OH(g)��ʵ����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��
CH3OH(g)��ʵ����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��
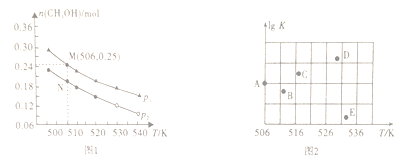
�ٸ÷�Ӧ�ġ�H_____0(�>������<����=��)���ж�������_______________��
��M��ʱ��CO��ת����Ϊ________��506Kʱ�÷�Ӧ��ƽ�ⳣ��K=________(������λС��)��
��ijͬѧ���Ƶ�ѹǿΪpʱ����ͬ�¶���������Ӧ��ƽ�ⳣ���Ķ���ֵ(lgK)��ͼ2��ʾ��A��B��C��D��E���������ȷ��ʾ�÷�Ӧ��lgK���¶�(T)�Ĺ�ϵ�ĵ�Ϊ____________��
������������˵����ӦCO(g)+2H2(g) ![]() CH3OH(g)�ﵽƽ��״̬����________(�����)��
CH3OH(g)�ﵽƽ��״̬����________(�����)��
A.��λʱ��������2molH2��ͬʱ����1molCO
B.��Ӧ������c(CO)��c(CH3OH)=1��1
C.���º���ʱ�����������ܶȱ��ֲ���
D.���Ⱥ���ʱ����Ӧ��ƽ�ⳣ�����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����������ѪС��ۼ���ҩ���ҩ��ϳ�·��ͨ����2-�ȱ���ȩΪԭ�ϵĺϳɣ��ϳ�·�����£�
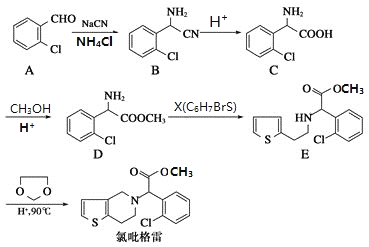
(1)���й�����������˵����ȷ����___________��
A.����������һ���������ܷ�����ȥ��Ӧ
B.��������������ˮ����һ���������ܷ���ˮ�ⷴӦ
C.lmol����������5NA��̼̼˫����һ���������������5molH2�����ӳɷ�Ӧ
D.�������ķ���ʽΪC16H16ClNO2S
(2)����D�ĺ˴Ź���������__________�����շ塣
(3)����X�Ľṹ��ʽΪ_____________��
(4)����C����һ�������·�Ӧ����һ�ֺ���3����Ԫ���IJ��д���÷�Ӧ�Ļ�ѧ����ʽ__________����Ӧ������______________��
(5)д�����ڷ����廯����A��ͬ���칹��______________(������A )
(6)��֪��![]() ��д������ϩ���״�Ϊ�л�ԭ���Ʊ�������
��д������ϩ���״�Ϊ�л�ԭ���Ʊ�������![]() �ĺϳ�·������ͼ__________________(���Լ���ѡ)��
�ĺϳ�·������ͼ__________________(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A. 12.4gP4���������õ��Ӷ�����Ϊ0.4NA
B. 25��ʱ��pH=l��HC1��Һ�к���H+����ĿΪ0.1NA
C. ��״���£�19gH218O2��������������Ϊ9NA
D. 1molSO2��0.5molO2���ݻ�ΪV�������г�ַ�Ӧ��ת�Ƶ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2����֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2��
(1)�÷�Ӧ�еĻ�ԭ����____________��
(2)�÷�Ӧ�У�������ԭ��Ӧ�Ĺ�����______________��______________��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ��������ת�Ƶķ������Ŀ��__________��
(4)����Ӧת����0.3 mol���ӣ�������������ڱ�״�������Ϊ__________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ʹ���۵⻯����Һ�������ǣ� ��
A.���Ƶ���ˮ
B.��ˮ
C.KBr
D.KI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOCl)���л��ϳ��е���Ҫ�Լ�������NO��Cl2��Ӧ�õ�����ѧ����ʽΪ2NO(g)��Cl2(g) ![]() 2NOCl(g)��
2NOCl(g)��
��1�����������������ڴ����еĺ������������ʱ�������������ȣ��漰���·�Ӧ��
��2NO2(g)��NaCl(s) ![]() NaNO3(s)��NOCl(g)
NaNO3(s)��NOCl(g)
��4NO2(g)��2NaCl(s) ![]() 2NaNO3(s)��2NO(g)��Cl2(g)
2NaNO3(s)��2NO(g)��Cl2(g)
��2NO(g)��Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
�跴Ӧ�٢ڢ۶�Ӧ��ƽ�ⳣ������ΪK1��K2��K3����K1��K2��K3֮��Ĺ�ϵΪ____________��
��2��300 ��ʱ��2NOCl(g) ![]() 2NO(g)��Cl2(g)������Ӧ���ʵı���ʽΪv����k��cn(NOCl)(kΪ���ʳ�����ֻ���¶��й�)�����������Ũ�ȵĹ�ϵ�����ʾ��
2NO(g)��Cl2(g)������Ӧ���ʵı���ʽΪv����k��cn(NOCl)(kΪ���ʳ�����ֻ���¶��й�)�����������Ũ�ȵĹ�ϵ�����ʾ��
��� | c(NOCl)/mol��L��1 | v/mol��L��1��s��1 |
�� | 0.30 | 3.60��10��9 |
�� | 0.60 | 1.44��10��8 |
�� | 0.90 | 3.24��10��8 |
n��________��k��________��
��3����1 L�����ܱ������г���2 mol NO(g)��1 mol Cl2(g)���ڲ�ͬ�¶��²��c(NOCl)��ʱ��t�Ĺ�ϵ��ͼA��ʾ����Ӧ��ʼ��10 minʱCl2��ƽ����Ӧ����v(Cl2)��________ mol��L��1��min��1��
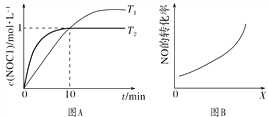
��4�����ܱ������г���NO(g)��Cl2(g)���ı��������[�¶ȡ�ѹǿ��![]() ��������ĽӴ����]��NO��ת���ʱ仯��ϵ��ͼB��ʾ��X����________��
��������ĽӴ����]��NO��ת���ʱ仯��ϵ��ͼB��ʾ��X����________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com