
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ������CO2��H2��һ�������·�Ӧ�ϳɼ״���
(1)��֪��
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H=-1275.6kJ��mol-1
��2CO(g)+O2(g)=2CO2(g) ��H=-566.0 kJ��mol-1
��H2O(g)=H2O(l) ��H=-44.0 kJ��mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ_______________________��
(2)���ݻ�Ϊ1L���ܱ������У�Ͷ��1molCO��2molH2���ڲ�ͬ�����·�����Ӧ��CO(g)+2H2(g) ![]() CH3OH(g)��ʵ����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��
CH3OH(g)��ʵ����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��
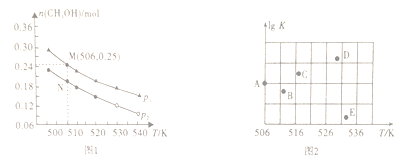
�ٸ÷�Ӧ�ġ�H_____0(�>������<����=��)���ж�������_______________��
��M��ʱ��CO��ת����Ϊ________��506Kʱ�÷�Ӧ��ƽ�ⳣ��K=________(������λС��)��
��ijͬѧ���Ƶ�ѹǿΪpʱ����ͬ�¶���������Ӧ��ƽ�ⳣ���Ķ���ֵ(lgK)��ͼ2��ʾ��A��B��C��D��E���������ȷ��ʾ�÷�Ӧ��lgK���¶�(T)�Ĺ�ϵ�ĵ�Ϊ____________��
������������˵����ӦCO(g)+2H2(g) ![]() CH3OH(g)�ﵽƽ��״̬����________(�����)��
CH3OH(g)�ﵽƽ��״̬����________(�����)��
A.��λʱ��������2molH2��ͬʱ����1molCO
B.��Ӧ������c(CO)��c(CH3OH)=1��1
C.���º���ʱ�����������ܶȱ��ֲ���
D.���Ⱥ���ʱ����Ӧ��ƽ�ⳣ�����ٱ仯
���𰸡� CH3OH(l)+O2(g)=CO(g)+2H2O(l) ��H=- 442.8kJ/mol �� ��ͼ���������¶����ߣ��״������ʵ������٣�˵��ƽ�������ƶ���������Ӧ���� 25% 0.148 ABE AD
��������(1)��֪����2CH3OH(l)+3O2(g)��2CO2(g)+4H2O(g) ��H=-1275.6kJ��mol-1
��2CO(g)+O2(g)��2CO2(g) ��H=-566.0 kJ��mol-1
��H2O(g)��H2O(l) ��H=-44.0 kJ��mol-1
���ݸ�˹���ɿ�֪���٣���+�ۡ�4��/2���õ��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH(l)+O2(g)��CO(g)+2H2O(l) ��H��-442.8kJ/mol��
(2)�ٴ�ͼ����Կ����������¶����ߣ��״������ʵ������٣�˵��ƽ�������ƶ�������Ӧ���ȣ���˸÷�Ӧ�ġ�H��0����M��ʱ�״���0.25mol�����ݷ���ʽ��֪����CO��0.25mol������CO��ת����Ϊ25%��ƽ��ʱ����������0.5mol��ʣ��CO�������ֱ���0.75mol��1.5mol���ݻ�Ϊ1L������506Kʱ�÷�Ӧ��ƽ�ⳣ��K��![]() ��������Ӧ���ȣ������¶�ƽ�����淴Ӧ������У�ƽ�ⳣ����С��lgK��С����������ȷ��ʾ�÷�Ӧ��lgK���¶�(T)�Ĺ�ϵ�ĵ�ΪABE����A.��λʱ��������2molH2��ͬʱ����1molCO��ʾ���淴Ӧ������ȣ��ﵽƽ��״̬��A��ȷ��B.��Ӧ������c(CO)��c(CH3OH)��1��1����˵�����淴Ӧ������ȣ���Ӧ��һ���ﵽƽ��״̬��B����C.�ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ���˺��º���ʱ�����������ܶȱ��ֲ��䲻��˵����Ӧ�ﵽƽ��״̬��C����D.���Ⱥ���ʱ����Ӧ��ƽ�ⳣ�����ٱ仯˵���¶Ȳ��ٷ����仯����Ӧ�ﵽƽ��״̬��D��ȷ����ѡAD��
��������Ӧ���ȣ������¶�ƽ�����淴Ӧ������У�ƽ�ⳣ����С��lgK��С����������ȷ��ʾ�÷�Ӧ��lgK���¶�(T)�Ĺ�ϵ�ĵ�ΪABE����A.��λʱ��������2molH2��ͬʱ����1molCO��ʾ���淴Ӧ������ȣ��ﵽƽ��״̬��A��ȷ��B.��Ӧ������c(CO)��c(CH3OH)��1��1����˵�����淴Ӧ������ȣ���Ӧ��һ���ﵽƽ��״̬��B����C.�ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ���˺��º���ʱ�����������ܶȱ��ֲ��䲻��˵����Ӧ�ﵽƽ��״̬��C����D.���Ⱥ���ʱ����Ӧ��ƽ�ⳣ�����ٱ仯˵���¶Ȳ��ٷ����仯����Ӧ�ﵽƽ��״̬��D��ȷ����ѡAD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�״���µ��������ʣ�
A��11.2 L O2 B��6.8 g NH3 C��1.204��1024 CH4 D��0.5 mol CO2��
������ɴ�С��˳����_______(����ţ���ͬ)�����������ɴ�С��˳��Ϊ__________��������ܶ��ɴ�С��˳����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬԪ�ؼ���ʵ������ǣ� ��
A.��������ͬ
B.��������ͬ
C.���ԭ��������ͬ
D.���Ӳ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������K2SO4��MgSO4��KNO3�����ᴿ,���Ƶ�KNO3��Һ,ijѧ�����������ʵ�鷽��:

(1).������Ϊ__________��
(2).������~�������Լ�����������Ϊ__________��
(3).����ж�SO42-�ѳ���?__________��
(4).ʵ������в����Ķ��ֳ���__________(������Ҫ����������Ҫ��)��ι���,��������__________��
(5).��ͬѧ��ʵ����Ʒ����Ƿ�����?__________(����������������������),��˵������:__________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������һ����ȷ����
A. 1molFe�����ˮ������Ӧ��ת�Ƶ��ӵ���ĿΪ3NA
B. ��״���£�2.24LHF�к��еļ��Լ���ĿΪ0.1NA
C. 5mL0.1mol/LCH3COOH��Һ��10mL0.5mol/LCH3COOH��Һ������CH3COOH���������
D. һ�������£���0.1L������ͨ��4.6gNO2���壬NO2�����ʵ���Ũ��С��1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����ɷֶ����ڵ���ʵ��ǣ� ��
A.���ᾧ���������Һ
B.����ؾ�����ۻ��������
C.���Ǿ�����ۻ�������
D.��ʯ�Һͳ���ʯ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��ص������кܶ࣬����һ�־������õ���ʵ�Ũ�Ȳ�ɡ�Ũ���ء������������ij���ӵ�Ũ��Խ��ʱ�������Ի�ԭ��Խǿ����ͼ���׳�Ϊ3mol��L-1��AgNO3��Һ���ҳ�Ϊ1mol��L-1��AgNO3��Һ��A��B��ΪAg�缫��ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1�����ֵ�����ָ�뷢��ƫת������˵������ȷ����

A. һ��ʱ��������ָ�뽫���㣬��ʱ����Ϊ��Ӧ���ٽ���
B. ��������ָ�����պ�K1���Ͽ�K2���ҳ���ҺŨ������
C. ��������ָ�����պ�K1���Ͽ�K2������Ag�缫��������
D. ʵ�鿪ʼ�ȱպ�K2���Ͽ�K1����ʱNO3-��B�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ȷ���ǣ� ��
ѡ�� | ���� | �� | �� | ���� |
A | ˮ�� | ���� | ���� | ��������Һ |
B | ��ˮ | ���� | �ռ� | �� |
C | C60 | ���� | ��ʯ�� | �� |
D | ���� | ̼�� | ������ͭ | ������������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ϊƽ���������εĽṹ������˵���д������(����)
A. ��������̼ԭ�Ӽ��γɵ�̼̼����ȫ��ͬ
B. ���������γɹ��ۼ��ļнǶ���120��
C. ��������6��̼ԭ��λ��ͬһƽ����
D. �������е�̼ԭ������ԭ�Ӳ���ͬһƽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com