
【题目】现有标准状况下的以下物质:
A.11.2 L O2 B.6.8 g NH3 C.1.204×1024 CH4 D.0.5 mol CO2;
其体积由大到小的顺序是_______(填序号,下同),其中质量由大到小的顺序为__________,气体的密度由大到小的顺序是_____________________。
【答案】C>A=D>B C>D>A>BD>A>B>C
【解析】
A.标况下11.2LO2的物质的量为11.2L÷22.4L/mol=0.5mol,m(O2)=0.5mol×32g/mol=16g;
B.6.8gNH3的物质的量为6.8g÷17g/mol=0.4mol;
C. 1.204×1024CH4的物质的量为![]() ,m(CH4)=2mol×16g/mol=32g;
,m(CH4)=2mol×16g/mol=32g;
D.0.5molCO2的质量m(CO2)=0.5mol×44g/mol=22g;
根据阿伏加德罗定律可知相同条件下体积之比等于物质的量之比,即体积由大到小的顺序是C>A=D>B,质量由大到小的顺序为C>D>A>B。相同条件下气体的密度之比等于摩尔质量之比,则其气体的密度由大到小的顺序是D>A>B>C。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙醇能使酸性高锰酸钾溶液褪色,被氧化生成CO2和H2O
B. ![]() 和C4Hl0的二氯代物的数目不同(不含立体异构)
和C4Hl0的二氯代物的数目不同(不含立体异构)
C. 乙烯能使溴水褪色、能使酸性KMnO4溶液褪色,它们发生反应的类型不同
D. 植物油通过氢化可以变成脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O②NH3+NO→HNO2+H2O③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系增加压强使颜色变深
H2(g)+I2(g)平衡体系增加压强使颜色变深
C. 反应CO+NO2![]() CO2+NO △H<0, 升高温度使平衡向逆方向移动
CO2+NO △H<0, 升高温度使平衡向逆方向移动
D. 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为amol的FeCl3和CuCl2投入水中形成混合溶液。再加入bmol铁粉充分反应(忽略离子的水解),下列说法中不正确的是( )
A. 当b≤![]() 时,发生的离子反应为2Fe3++Fe=3Fe2+
时,发生的离子反应为2Fe3++Fe=3Fe2+
B. 当b≥![]() 时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
C. 当![]() <b<
<b<![]() 时,反应中转移电子的物质的量:amol<n(e-)<3amol
时,反应中转移电子的物质的量:amol<n(e-)<3amol
D. 当![]() <b<
<b<![]() 时,反应后的溶液中n(Cu2+)∶m(Fe2+)=(
时,反应后的溶液中n(Cu2+)∶m(Fe2+)=(![]() -b)∶(b+a)
-b)∶(b+a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可证明氨水是弱碱的是 ( )
A. 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B. 铵盐受热易分解
C. 0.1mol/L氨水可以使酚酞试液变红 D. 0.1mol/L氯化铵溶液的pH为5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)S2﹣中含有 18 个电子,画出 S 的原子结构示意图_____.
(2)一水合氨(NH3H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧 根离子,试写出一水合氨的电离方程式_____.
(3)正长石的组成可表示为 KAlSi3Ox,试根据化合价计算 x=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
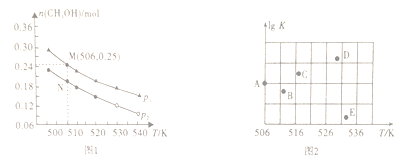
①该反应的△H_____0(填“>”、“<”或“=”),判断理由是_______________。
②M点时,CO的转化率为________。506K时该反应的平衡常数K=________(保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________。
④下列叙述能说明反应CO(g)+2H2(g) ![]() CH3OH(g)达到平衡状态的是________(填序号)。
CH3OH(g)达到平衡状态的是________(填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com