
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
【答案】B
【解析】A项,如图,为Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线,曲线上的点都代表平衡状态,则Ksp[Ca(OH)2]=c(Ca2+)c2(OH-)=10-7,Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,a点的浓度商Q[Ca(OH)2]=c(Ca2+)c2(OH-)=10-18小于Ksp[Ca(OH)2],Q(CaWO4)=c(Ca2+)c(WO42-)=10-12小于与Ksp(CaWO4),所以a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态,故A正确。B项,设饱和Ca(OH)2溶液中,c(Ca2+)=x,则c(OH-)=2x,根据Ksp[Ca(OH)2]=c(Ca2+)c2(OH-)=10-7,则x(2x)2=10-7,解得x=![]() ;设饱和CaWO4溶液中,c(Ca2+)=y,则c(WO42-)=y,根据Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,则y2=10-10,解得y=10-5;混合时:c(Ca2+)=
;设饱和CaWO4溶液中,c(Ca2+)=y,则c(WO42-)=y,根据Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,则y2=10-10,解得y=10-5;混合时:c(Ca2+)=![]() (
(![]() )≈
)≈![]()
![]() =
=![]() =
=![]() ,c(OH-)=
,c(OH-)=![]() ,c(H+)=
,c(H+)=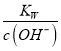 =0.29×10-12,c(WO42-)=
=0.29×10-12,c(WO42-)=![]() ×10-5,Q(CaWO4)=c(Ca2+)c(WO42-)=
×10-5,Q(CaWO4)=c(Ca2+)c(WO42-)=![]() ×
×![]() ×10-5大于Ksp(CaWO4),所以混合后会析出CaWO4,但是溶液中减小的c(Ca2+)=c(WO42-)肯定会小于
×10-5大于Ksp(CaWO4),所以混合后会析出CaWO4,但是溶液中减小的c(Ca2+)=c(WO42-)肯定会小于![]() ×10-5,所以沉淀后溶液中c(Ca2+)还是10-2级别,根据Ksp(CaWO4)=10-10可推出c(WO42-)是10-8级别,而前面已求得c(H+)=0.29×10-12。综上分析,c(OH-)>c(Ca2+)>c(WO42-)>c(H+),故B错误。C项,Na2O和水反应使水减少,饱和Ca(OH)2溶液中,Q[Ca(OH)2]>Ksp[Ca(OH)2],析出Ca(OH)2固体,所以溶液变浑浊,故C正确。D项,由前面的分析可知CaWO4比Ca(OH)2更难溶,所以石灰乳与0.1mol/LNa2WO4溶液混合后,会发生反应Ca(OH)2+WO42-=CaWO4+2OH-,实现沉淀的转化,故D正确。
×10-5,所以沉淀后溶液中c(Ca2+)还是10-2级别,根据Ksp(CaWO4)=10-10可推出c(WO42-)是10-8级别,而前面已求得c(H+)=0.29×10-12。综上分析,c(OH-)>c(Ca2+)>c(WO42-)>c(H+),故B错误。C项,Na2O和水反应使水减少,饱和Ca(OH)2溶液中,Q[Ca(OH)2]>Ksp[Ca(OH)2],析出Ca(OH)2固体,所以溶液变浑浊,故C正确。D项,由前面的分析可知CaWO4比Ca(OH)2更难溶,所以石灰乳与0.1mol/LNa2WO4溶液混合后,会发生反应Ca(OH)2+WO42-=CaWO4+2OH-,实现沉淀的转化,故D正确。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已称量好的氯化钠固体配制500 mL 0.40 mol·L-1氯化钠溶液, 仪器不用的是
①250 mL容量瓶 ②托盘天平 ③500 mL容量瓶④胶头滴管
⑤烧杯 ⑥玻璃棒 ⑦药匙
A.③⑥⑦B.①②④C.①②⑦D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下面是几种实验中常用的仪器:
写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________
II实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各问题
(1)泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:________;
(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出①电荷守恒__________________;②物料守恒______________________;③质子守恒______________________________;④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
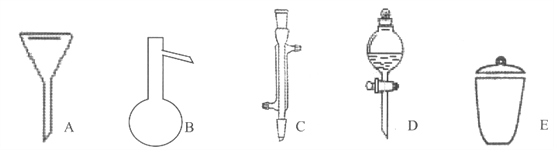
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定形硼最可靠的科学方法为________。晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。若每个单元中有两个原子为10B,其余为11B,则该单元结构的类型有___种。
(2)NaBH4是一种重要的储氢载体,阴离子结构式为________。
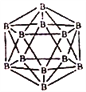
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数)。
(4)硼酸晶体是片层结构,有与石墨相似的层状结构,图2表示的是其中一层的结构。硼酸晶体中存在的作用力有共价键、________、________。与H3BO3酸性最接近的是________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是____________________。
(5)镁的堆积方式为________________,配位数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )

A. 铜电极应与X相连接
B. H+透过质子交换膜由右向左移动
C. M电极反应式为CO(NH2)2+H2O-6e-===CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,则理论上铁电极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法错误的是( )

A. 电池工作时,电子从电极a经负载流向电极b
B. 实际工作中当反应生成64gS2时,电池内部释放632kJ电能
C. 电极a上发生的电极反应为:2H2S - 4e-=S2 + 4H+
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com