
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )

A. 铜电极应与X相连接
B. H+透过质子交换膜由右向左移动
C. M电极反应式为CO(NH2)2+H2O-6e-===CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,则理论上铁电极增重16 g
【答案】C
【解析】A.分析装置甲可知,N电极上由氧气转化为水,氧元素得到电子,发生还原反应,则N电极为原电池的正极;要用乙装置在铁上镀铜,根据电镀原理,铜棒作阳极,铁棒作阴极,所以铜电极要与Y相连,故A错误;装置甲的N极(即正极)反应为O2+4H++4e-=2H2O,M极(即负极)由题干分析可知其电极反应为CO(NH2)2+H2O-6e-=N2↑+CO2↑+6H+,所以H+向N极移动,即由左向右移动,故B错误,C正确;D、当N电极消耗0.25mol气体时,转移n(e-)=0.25mol×4=1mol,根据各电路中电子转移守恒可知,在铁电极上析出铜的质量为m(Cu)= ![]() ×64g/mol=32g,故D错误。本题正确答案为C。
×64g/mol=32g,故D错误。本题正确答案为C。


科目:高中化学 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2 HI(g)![]() H2(g) + I2(g)平衡体系增大压强使气体颜色变深
H2(g) + I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2 + H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,分子数相同的是( )
A.2L SO2和2L CO2B.标准状况下1mol氧气和22.4L水
C.9g水和标准状况下11.2L CO2D.0.2molH2S和2.24LHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组测定某蛋白质的组成(假定只含C、H、O、N元素),设计如下实验(夹持装置略去)。
I.样品中碳、氢含量的测定

(1)仪器a的名称为___________________________。
(2)导管g的作用为______________________________________。
(3)选择上述装置,按气流从左到右的方向,合理的连接顺序为____________________(填大写字母,仪器可重复使用)→排水法收集气体装置。
(4)称取4.65g蛋白质样品,用上述连接好的装置进行实验。
①充分反应后,熄灭D处酒精灯之前,需继续通入O2至硬质玻璃管冷却,原因为__________________。
②充分反应后,测得用于接收气体产物的碱石灰和P2O5分别增重7.7g、2.25g。
Ⅱ.样品中氮元素含量的测定
已知:在催化剂存在下,浓硫酸能将样品中的氮元素转化为铵盐。
i.重新称取4.65g蛋白质样品,将其中的氮元素全部转化为铵盐;
ii.所得铵盐与足量NaOH溶液反应,并用100mLl mol·L-l盐酸将生成的氨气全部吸收;
iii.将吸收液稀释至500mL;
iv.取25.00mL稀释后的溶液,用0.1000 mol·L-l的NaOH溶液平行滴定,平均消耗标准液25.00mL。
(5)蛋白质样品中C、H、N、O的原子数目之比为_____________________。若步骤iii中定容时仰视容量瓶刻度线,则所测氮元素含量___________(填“偏高”“偏低”或“无影响”)。
(6)有同学认为,通过(3)中收集到的气体体积即可得到氮元素的含量,你认为其观点___________(填“正确”或“不正确”),理由为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萘及其取代物是重要的有机合成材料和药物中间体。实验室由芳香化合物A和烃B制备1-乙基萘(M)的一种合成路线如下:

已知:Ⅰ.B的核磁共振氢谱中有2组吸收峰
Ⅱ. 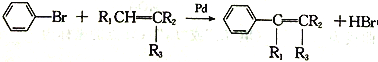 (R1、R2、R3表示H原子或烃基)
(R1、R2、R3表示H原子或烃基)
Ⅲ. 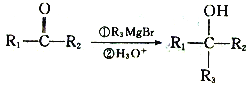 (R1、R2、R3表示H原子或烃基)
(R1、R2、R3表示H原子或烃基)
请回答下列问题:
(1)A的化学名称为________________,,B的结构简式为________________________。
(2)B→C的反应类型为_______________________。
(3)D的分子式为_____________________,F中官能团的名称为_______________________。
(4)G→H的化学方程式为_____________________________。
(5)含有萘环的M的同分异构体还有_______种;其中核磁共振氯谱为四组峰的结构简式_________(任写一种)。
(6)参照上述合成路线和信息,以丙酮和溴苯为原料(其他无机试剂任选),设计制备![]() 的合成路线_______________________________________。
的合成路线_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:
VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+
VO2+(黄色)+V2+(绿色)+2H+
下列说法错误的
A. 充电时,反应每生成2mol H+时电子转移的物质的量为2mol
B. 放电过程中,正极附近溶液的酸性减弱
C. 放电时,正极反应为VO2++2H++e-=VO2++H2O
D. 充电时,阳极附近溶液由蓝色逐渐变为黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com