
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
【答案】(1) 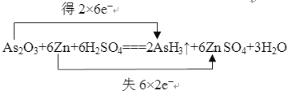
(2)A
(3)ZnSO4 AsH3
(4)1.2NA
【解析】(1)在As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
(2)As2O3中As元素的化合价降低,发生还原反应,作氧化剂,所以表现为氧化性。
(3)该反应中Zn被氧化,氧化产物是ZnSO4,As被还原,还原产物是AsH3。
(4)由双线桥可知,生成2 mol AsH3,转移电子12 mol,若生成0.2 mol AsH3,则转移电子的物质的量是1.2 mol,电子数是1.2NA。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种比黄金贵百倍的18O2气体,不久前在兰州近代物理研究所制备成功.1mol18O2气体中所含中子的物质的量为( )
A.16mol
B.18mol
C.20mol
D.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中属于人工固氮的是( )
A.雷雨天气时产生少量NO
B.往农田中施放铵态氮肥
C.豆科植物等根部的根瘤菌吸收空气中的氮气转变为氨
D.N2和H2在高温、高压和催化剂存在下合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2 HI(g)![]() H2(g) + I2(g)平衡体系增大压强使气体颜色变深
H2(g) + I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2 + H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,分子数相同的是( )
A.2L SO2和2L CO2B.标准状况下1mol氧气和22.4L水
C.9g水和标准状况下11.2L CO2D.0.2molH2S和2.24LHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用。下列化学反应中,不符合绿色化学概念的是
A. 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3
B. 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O
C. 制硫酸铜:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制硫酸铜:2Cu+O2![]() 2CuO , CuO+H2SO4(稀)=CuSO4+H2O
2CuO , CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com