
【题目】一种比黄金贵百倍的18O2气体,不久前在兰州近代物理研究所制备成功.1mol18O2气体中所含中子的物质的量为( )
A.16mol
B.18mol
C.20mol
D.24mol
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.金属钠的熔点很高
C.做钠与水反应时,要用到的仪器有镊子、小刀、滤纸、烧杯、玻璃片
D.将金属钠放在石棉网上加热后,金属钠剧烈燃烧,产生黄色火焰,生成白色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
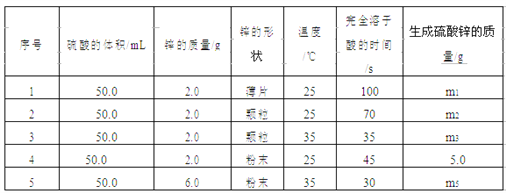
(1)本实验中实验 2 和实验 3 表明________对反应速率有影响。
(2)若采用与实验 1 完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
Ⅱ.某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
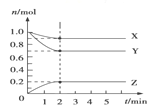
(3)反应开始至 2 min,Y 的平均反应速率_______mol/(L·min)。
(4)反应开始至 2 min,X 的转化率________。
(5)写出 X、Y、Z 的反应方程式________________。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,则负极电极反应式为________。反应进行后,溶液的 pH________(填“增大”、“减小”或“不变”)。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池。则负极材料为_______,正极材料为______。正极反应式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】217年5月4日《光明日报》报道称,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了 CO2直接加氢制汽油的过程。其转化过程如图所示。
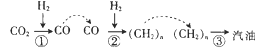
下列说法正确的是
A. 反应①的产物中含有水
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气中不含氮氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 14C常用于测定生物遗骸的年份.下列说法中正确的是( )
A.14C相对原子质量等于14
B.14C与14N中子数一定不同
C.14C与C60互为同素异形体
D.14C与12C是两种不同的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
A. 容器体积不变,升温正、逆反应速率均增大
B. 温度、压强均不变,充入氦气,正、逆反应速率不变
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容积、温度不变,充入氦气后,正、逆反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸在水溶液中建立如下电离平衡: CH3COOH![]() H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是
H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是
A. 通氯化氢气体 B. 加入少量醋酸钾固体
C. 加入少量氢氧化钠固体 D. 通入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com