
 如图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数.下列叙述正确的是( )
如图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数.下列叙述正确的是( )| A、A元素位于第二周期、ⅥA族 |
| B、原子半径C>B>A |
| C、在一定条件下,A、B的气态氢化物都能够与氧气反应 |
| D、三种元素都存在最高价含氧酸,且都显强酸性 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
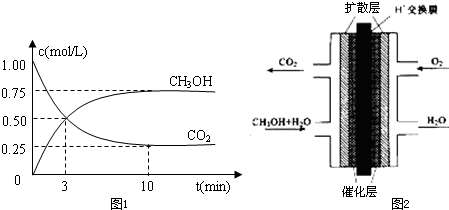
| n(CH3OH) |
| n(CO2) |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将食物储存在冰箱里 |
| B、往H2O2溶液中加入几滴FeCl3溶液 |
| C、用粉末状碳酸钙代替块状碳酸钙与稀盐酸反应 |
| D、用稀H2SO4溶液与锌粒反应时加入几滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,33.6L CO2中含有氧原子数为3NA |
| B、1 mol OH-和1 mol-OH(羟基)所含质子数均为9NA |
| C、常温下,100mL 0.1mol?L-1醋酸钠溶液中含醋酸根的数目小于0.01NA |
| D、50mL 18.4mol?L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的导电性差 |
| B、在溶液中离子与离子间存在电离平衡 |
| C、溶解度小 |
| D、在溶液中存在分子和离子之间的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
| B、2 g氢气所含原子数目为NA |
| C、在常温常压下,11.2 L氮气所含的原子数目为NA |
| D、17 g氨气所含电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入氯气,溶液中氢离子浓度增大 |
| B、通入过量H2S,反应后溶液pH减小 |
| C、加入氢氧化钠溶液,平衡向右移动,pH变小 |
| D、加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com