


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、H+,Na+,SO42-,NO3- |
| B、Ba2+,NH4+,OH-,MnO4- |
| C、H+,K+,Cl-,CO32- |
| D、Na+,Fe2+,NO3-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
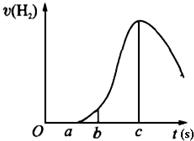 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数.下列叙述正确的是( )
如图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数.下列叙述正确的是( )| A、A元素位于第二周期、ⅥA族 |
| B、原子半径C>B>A |
| C、在一定条件下,A、B的气态氢化物都能够与氧气反应 |
| D、三种元素都存在最高价含氧酸,且都显强酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com