
| 25.6g |
| 64g/mol |
| ||
| 25.6g |
| 64g/mol |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.4mol |
| 4 |


科目:高中化学 来源: 题型:
| A、Na与H2O反应 |
| B、NaOH溶液与H2SO4溶液反应 |
| C、Al与Fe2O3反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
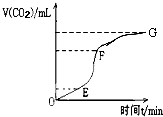 请用相关知识回答下列问题:
请用相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
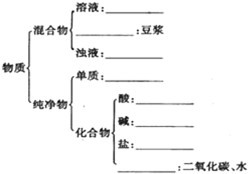 有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)
有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
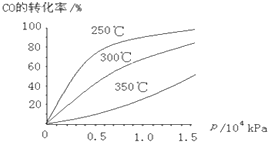 Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)
Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)查看答案和解析>>
科目:高中化学 来源: 题型:
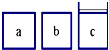 如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:
如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,33.6L CO2中含有氧原子数为3NA |
| B、1 mol OH-和1 mol-OH(羟基)所含质子数均为9NA |
| C、常温下,100mL 0.1mol?L-1醋酸钠溶液中含醋酸根的数目小于0.01NA |
| D、50mL 18.4mol?L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com