
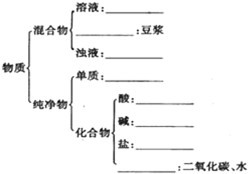
 有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)
有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)

科目:高中化学 来源: 题型:
| A、6 | B、7 | C、8 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
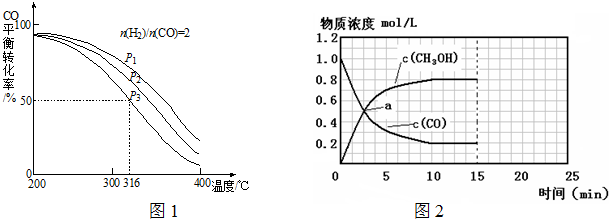
| 温度 (℃) | 250 | 300 | 350 |
| 平衡常数(k) | 2.04 | 0.25 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
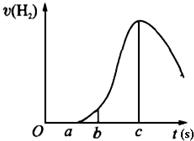 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
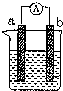 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液与NaOH溶液混合:OH-+NH4+═NH3?H2O |
| B、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| C、将铝粉投入氢氧化钠溶液中:Al+2OH-═2AlO2- |
| D、NaHCO3溶液与盐酸混合:HCO3-+H+═CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com