二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得.
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H
2(g)?CH
3OH(g)△H
1=-90.7kJ?mol
-1②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ?mol
-1③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3=-41.2kJ?mol
-1则反应3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)的△H=
kJ?mol
-1.
(2)将合成气以
通入1L的反应器中,一定条件下发生反应:
4H
2(g)+2CO(g)?CH
3OCH
3(g)+H
2O(g)
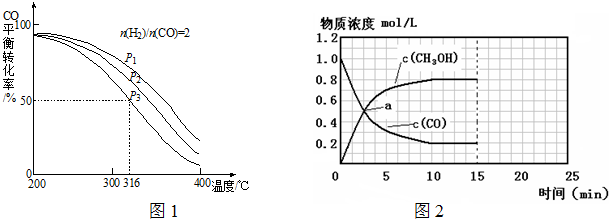
其中CO的平衡转化率随温度、压强变化关系如图1:
①该反应的平衡常数表达式为
;P
1、P
2、P
3由大到小的顺序为
.
②若反应在P
3和316℃时,起始时
=3,则达到平衡时,CO的转化率
50%(填“大于”、“小于”或“等于”).
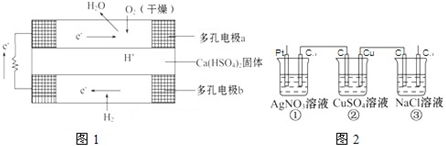
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,
| 温度 (℃) |
250 |
300 |
350 |
| 平衡常数(k) |
2.04 |
0.25 |
0.01 |
250℃时,将2mol CO和6mol H
2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为
;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为
(从上表中选),请在图中画出15-25分钟c(CH
3OH)的变化曲线.
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH
3OH+H
2SO
4→CH
3HSO
4+H
2O,CH
3HSO
4+CH
3OH→CH
3OCH
3+H
2SO
4.与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
.


 ;
; ;
;

 已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸:
已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸: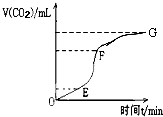 请用相关知识回答下列问题:
请用相关知识回答下列问题: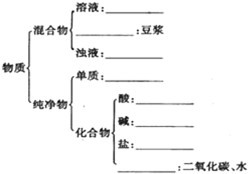 有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)
有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)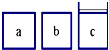 如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:
如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问: