
| 11.2L |
| 22.4L/mol |
| 10.8g |
| 108g/mol |
| 0.1mol |
| 2 |


 ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��ij���ӽṹʾ��ͼΪ�� �����Ա�ʾ35Cl-��Ҳ���Ա�ʾ37Cl- �����Ա�ʾ35Cl-��Ҳ���Ա�ʾ37Cl- |
| B��XԪ������������Ӧ��ˮ����ΪH2XO3����������̬�⻯��ΪH2X |
C��������̼���ӵı���ģ�ͣ� |
| D��������Ϊ8��������Ϊ10�ĺ��أ�10O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��6 | B��7 | C��8 | D��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢݢޢ� | B���ڢۢޢ� |
| C���٢ܢݢߢ� | D���ڢޢߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A | B | C | D | |
| ʵ�� Ŀ�� |
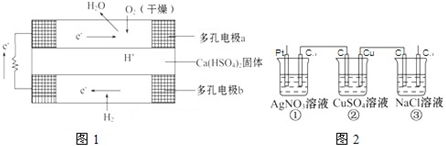
���װ�������� | ʵ�����ô����ϡ�����Ʊ�������̼ | ����֪Ũ�ȵ�����������Һ�ⶨδ֪Ũ������ | �ӵ��CCl4��Һ�з������ |
| ʵ��װ�� | 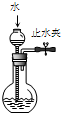 |
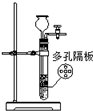 |
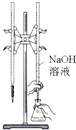 |
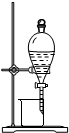 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
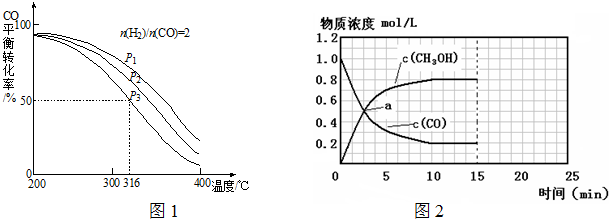
| �¶� ���棩 | 250 | 300 | 350 |
| ƽ�ⳣ����k�� | 2.04 | 0.25 | 0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com