
| A | B | C | D | |
| 实验 目的 |
检查装置气密性 | 实验室用纯碱和稀硫酸制备二氧化碳 | 用已知浓度的氢氧化钠溶液测定未知浓度盐酸 | 从碘的CCl4溶液中分离出碘 |
| 实验装置 | 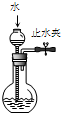 |
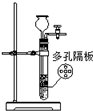 |
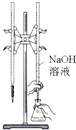 |
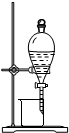 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、64.7% |
| B、47.5% |
| C、32.2% |
| D、28.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
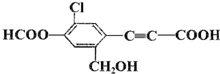 ,关于该有机物描述正确的是( )
,关于该有机物描述正确的是( )| A、该有机物分子式为:C11H5O5Cl |
| B、分子中最多有9个碳原子共平面 |
| C、1mol 该有机物分别与Na、NaOH、NaHCO3完全反应,消耗Na、NaOH、NaHCO3的物质的量依次为:2mol、5mol、1mol |
| D、该有机物不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与H2O反应 |
| B、NaOH溶液与H2SO4溶液反应 |
| C、Al与Fe2O3反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 盐酸 | 纯碱 | 食盐 | 二氧化硫 |
| B | 硫酸氢钠 | 烧碱 | 硫酸铜 | 一氧化碳 |
| C | 醋酸 | 氢氧化钠 | 生石灰 | 水 |
| D | 碳酸 | 氢氧化钾 | 小苏打 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
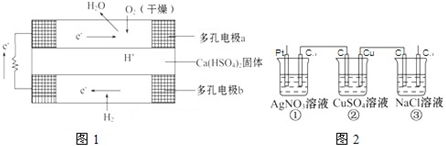
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
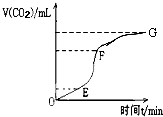 请用相关知识回答下列问题:
请用相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
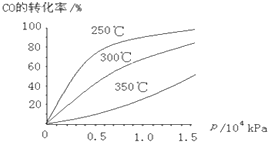 Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)
Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com