
 Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)
Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)| 各个产物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| 各个产物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| 0.52 |
| 1×0.5 |
| x2 |
| (1.5-x)(1-x) |
| 0.6 |
| 1.5 |
 SO3(g)+NO(g)
SO3(g)+NO(g)| a-x |
| 2a-x |
| 1 |
| 6 |
| 4 |
| 5 |
| x2 |
| (a-x)(2a-x) |
| 8 |
| 3 |
| 8 |
| 3 |


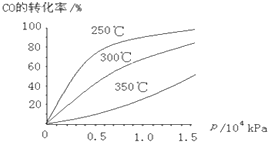
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 目的 |
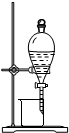
检查装置气密性 | 实验室用纯碱和稀硫酸制备二氧化碳 | 用已知浓度的氢氧化钠溶液测定未知浓度盐酸 | 从碘的CCl4溶液中分离出碘 |
| 实验装置 | 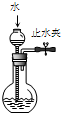 |
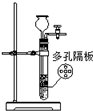 |
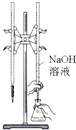 |
 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
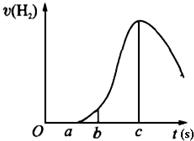 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
252 98 |
A、
| ||
B、
| ||
C、
| ||
| D、锎元素位于第6周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com