
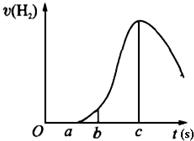
 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:| △c |
| △t |
| V |
| 22.4 |
| V |
| 22.4 |
| ||||
| (c-b)s |
| V |
| 11.2(c-b ) |
| V |
| 11.2(c-b ) |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
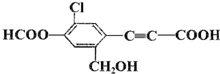 ,关于该有机物描述正确的是( )
,关于该有机物描述正确的是( )| A、该有机物分子式为:C11H5O5Cl |
| B、分子中最多有9个碳原子共平面 |
| C、1mol 该有机物分别与Na、NaOH、NaHCO3完全反应,消耗Na、NaOH、NaHCO3的物质的量依次为:2mol、5mol、1mol |
| D、该有机物不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
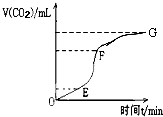 请用相关知识回答下列问题:
请用相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 260℃ | 280℃ | 295℃ | 310℃ |
| CO转化率 | 89% | 80% | 75% | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
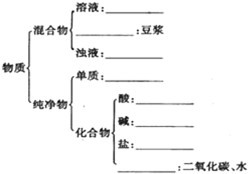 有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)
有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
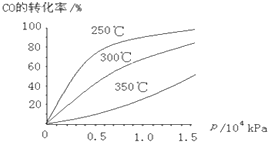 Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)
Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com