
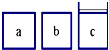
 如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:
如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:

科目:高中化学 来源: 题型:
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
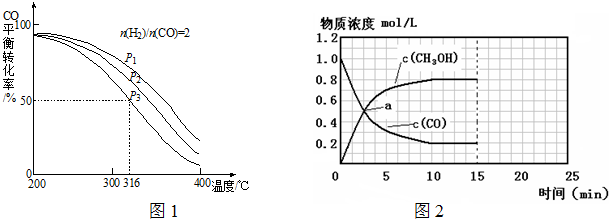
| 温度 (℃) | 250 | 300 | 350 |
| 平衡常数(k) | 2.04 | 0.25 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| 过量NaOH溶液 |
| 过量盐酸 |
| 过量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液与NaOH溶液混合:OH-+NH4+═NH3?H2O |
| B、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| C、将铝粉投入氢氧化钠溶液中:Al+2OH-═2AlO2- |
| D、NaHCO3溶液与盐酸混合:HCO3-+H+═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:W2R>W2Q |
| B、P与R形成化合物中,阴、阳离子个数比一定为1:2 |
| C、原子半径:W<R<Q<P |
| D、Q元素形成的酸一定是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com