
【题目】化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.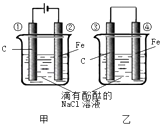
(1)把化学能转化为电能的装置是(填“甲”或“乙”)
(2)④电极上的电极反应式为
(3)①电极上的电极反应式 , 检验该电极反应产物的方法是
(4)甲、乙两装置电极附近的溶液首先变红的电极分别是、(填序号)
(5)写出装置甲的反应总方程式 .
【答案】
(1)乙
(2)Fe﹣2e﹣═Fe2+
(3)2Cl﹣﹣2e﹣═Cl2↑;把湿润的淀粉KI试纸置于①极附近,若试纸变蓝,则说明有Cl2生成
(4)②;③
(5)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
【解析】解:(1)没有外接电源且能自发进行氧化还原反应的装置为原电池,原电池将化学能转化为电能,乙装置能自发进行氧化还原反应,符合原电池条件,所以乙属于原电池,所以答案是:乙;(2)乙装置为原电池,铁易失电子作负极,碳作正极,所以④电极上电极反应式为:Fe﹣2e﹣═Fe2+ , 所以答案是:Fe﹣2e﹣═Fe2+;(3)甲装置为电解池,碳作阳极,阳极①上氯离子放电生成氯气,电极反应式为2Cl﹣﹣2e﹣═Cl2↑,氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验,如果试纸变为蓝色,说明有氯气生成,所以答案是:2Cl﹣﹣2e﹣═Cl2↑;把湿润的淀粉KI试纸置于①极附近,若试纸变蓝,则说明有Cl2生成;(4)甲装置中,阴极上氢离子放电,同时电极附近生成氢氧根离子,乙装置中碳电极上氧气得电子和水反应生成氢氧根离子,酚酞试液遇碱变红色,所以甲、乙两装置电极附近的溶液首先变红的电极分别是②、③,所以答案是:②;③;(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电生成氢气,所以电池反应式为2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑.
2NaOH+Cl2↑+H2↑.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥不同元素组成的多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A. ①③⑤ B. ②④⑥ C. ①③④ D. ③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )
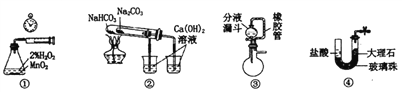
A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.Mg2+、H+、Cl-、HCO3-B.K+、NH4+、NO3-、CO32-
C.NH4+、Na+、SO42-、OH-D.Ag+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。

A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________

Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:

(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氯水的说法正确的是( )
A.能使湿润的有色布条褪色,说明氯水中有Cl2
B.溶液呈黄绿色,有刺激性气味,说明氯水中有Cl2
C.加入盐酸酸化的BaCl2溶液产生白色沉淀,说明氯水中有Cl-
D.加入NaOH溶液,黄绿色消失,说明氯水中有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题:
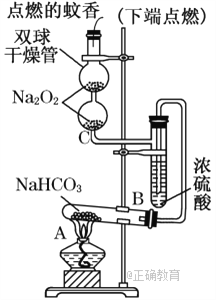
(1)在A试管内发生反应的化学方程式是____________________________________.
(2)B装置的作用是_______________________________________________________.
(3)在双球干燥管内发生反应的化学方程式为___________________________________.
(4)双球干燥管内观察到的实验现象是_________________________________________.上述实验现象说明________________________________________________________.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
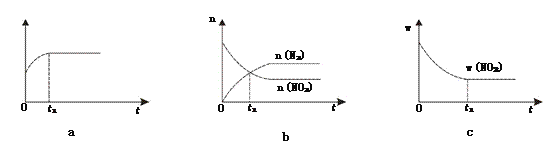
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
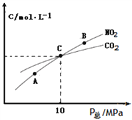
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
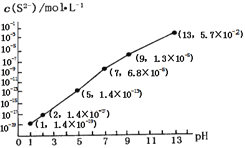
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为某套实验装置的示意图,其中加热装置和部分药品等均已省略(装置Ⅰ和装置Ⅱ为气体发生装置)。
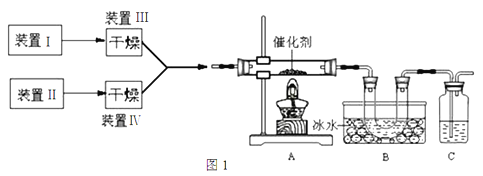
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)
制备NO2并验证其性质。
①装置Ⅰ用于实验室制备NH3,装置Ⅱ制备过量O2。装置Ⅰ中发生反应的化学方程式为_____________________。
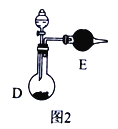
②也可以将制气体装置Ⅰ、Ⅱ、Ⅲ、Ⅳ合并为一个装置,如图2所示。若分液漏斗中盛装浓氨水,则D中的固体试剂为_______(填化学式),E中的试剂为____________。
(2)乙同学用此套装置合成SO3,B装置U形管中有固体出现。
①实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.0%的亚硫酸钠(质量分数)被氧化为硫酸钠,则至少需称取该亚硫酸钠的质量为______g(保留一位小数)。
②现欲制得纯净干燥的SO3,若图1装置C中盛放NaOH溶液,则此装置中存在明显不足:
a.C中的水蒸气可能进入B中与SO3反应;b.____________________________________。
应如何改进:______________________________(从下图给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
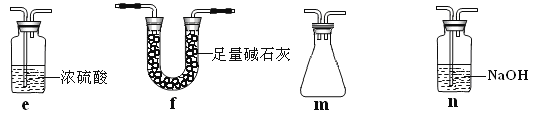
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置Ⅰ、装置Ⅱ分别制取NO和NH3),将图1装置中A、B、C分别换成图5中装置Ⅴ、Ⅵ、Ⅶ。
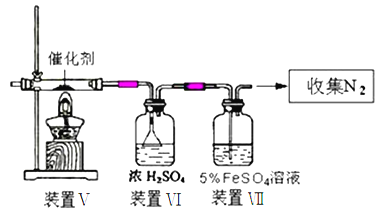
①写出氨气被NO氧化的化学方程式:___________________________。
②装置Ⅶ的作用可能是__________________________。
③若进入装置Ⅴ的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到11.2LN2,则NO的转化率是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com