
����Ŀ����ѧ�һ���̽���¼�����CO2�����ۺ����á�
��CO2�������ϳɵ�̼ϩ����2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H=akJ/mol
CH2=CH2(g)+4H2O(g) ��H=akJ/mol
��ش�
��1����֪��H2��CH2=CH��ȼ���ȷֱ���285.8kJ/mol��1411.0kJ/mol����H2O(g)![]() H2O(��1����H=-44.0kJ/mol����a=________kJ/mol��
H2O(��1����H=-44.0kJ/mol����a=________kJ/mol��
��2��������CO2�ϳ�CH2=CH2�ķ�Ӧ��________���Է�����(����¡����¡�)��
��3�������Ϊ1L�ĺ����ܱ������У�����3molH2��1molCO2������¶ȶ�CO2��ƽ��ת���ʺʹ�����Ч�ʵ�Ӱ����ͼ1��ʾ������˵����ȷ����________��

A��ƽ�ⳣ����С��KMN
B��������������,����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ�ڵ�M1
C��ͼ1��M��ʱ,��ϩ���������Ϊ7.7%
D����ѹǿ��n(H2)/n(CO2)����ʱ����֤����ѧ��Ӧ�Ѵﵽƽ��״̬
��4�������¶Ȳ���,�����ΪV L�ĺ�����������n(H2)��n(CO2)=3��1��Ͷ�ϱȼ��뷴Ӧ��,t0ʱ�ﵽ��ѧƽ�⡣����ͼ2�����������ڻ�������ƽ����Է�������![]() ��ʱ��仯��ͼ��___________
��ʱ��仯��ͼ��___________

�����á�Na-CO2����ؽ�CO2���Ϊ�����ҹ�������Ա���Ƴ��Ŀɳ�硰Na-CO2�����,���Ʋ��Ͷ��̼����(MWCNT)Ϊ�缫����,�ܷ�ӦΪ4Na+3CO2![]() 2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2,�乤��ԭ����ͼ3��ʾ��
2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2,�乤��ԭ����ͼ3��ʾ��

��5���ŵ�ʱ,�����ĵ缫��ӦʽΪ__________________��
��6�������ɵ�Na2CO3��Cȫ���������������棬��ת��0.2mole-ʱ���������ӵ�����Ϊ_______g��
��7��ѡ�ø��������ĸʴ������������Һ���ŵ���_____________________��
���𰸡� -127.8 ���� C  ����ͼҪ��O������(0,12.5)��t0ƽ��ʱ
����ͼҪ��O������(0,12.5)��t0ƽ��ʱ![]() ��12.5��20֮�䡣�� 3CO2+4Na++4e-=2Na2CO3+C 11.2 �����Ժá�������Ʋ���Ӧ���ѻӷ����ص�
��12.5��20֮�䡣�� 3CO2+4Na++4e-=2Na2CO3+C 11.2 �����Ժá�������Ʋ���Ӧ���ѻӷ����ص�
��������I.(1). �� H2(g)+1/2O2(g)=H2O(l) ��H=285.8kJ/mol��
�� C2H4(g)+3O2(g)=2H2O(l)+2CO2(g) ��H=1411.0kJ/mol��
�� H2O(g)�TH2O(l) ��H=44kJ/mol
���ݸ�˹���ɣ�6���٢�4���۵�2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H=6��(285.8kJ/mol)(1411.0kJ/mol)4��(44kJ/mol)= 127.8kJ/mol���ʴ�Ϊ��127.8��
CH2=CH2(g)+4H2O(g) ��H=6��(285.8kJ/mol)(1411.0kJ/mol)4��(44kJ/mol)= 127.8kJ/mol���ʴ�Ϊ��127.8��
(2). �������������Ȼ�ѧ����ʽ��֪����H<0������Ϊ���ȷ�Ӧ��2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)��Ӧǰ�����������С���ر��S<0��Ҫ�����HT��S<0��Ӧ�ڵ��������Է����У��ʴ�Ϊ�����£�
CH2=CH2(g)+4H2O(g)��Ӧǰ�����������С���ر��S<0��Ҫ�����HT��S<0��Ӧ�ڵ��������Է����У��ʴ�Ϊ�����£�
(3). A. �����¶ȶ�����̼��ƽ��ת���ʽ��ͣ�������ƽ�������ƶ�������M�㻯ѧƽ�ⳣ������N�㣬��A����B. ��������ʹƽ�ⷢ���ƶ�����ͼ���֪�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת����λ�ڵ�M����B����C. �����Ϊ1L�ĺ����ܱ������У�����3mollH2��1molCO2��ͼ��M��ʱ������̼ת����Ϊ50%��
6H2(g)+2CO2(g) ![]() CH2=CH2 (g)+4H2O(g)
CH2=CH2 (g)+4H2O(g)
��ʼ��(mol) 3 1 0 0
�仯��(mol) 1.5 0.5 0.25 1
ƽ����(mol) 1.5 0.5 0.25 1
����CH2=CH2���������=![]() ��100%=7.7%����C��ȷ��D���ɷ���ʽ��֪����ѹǿ����ʱ��˵����Ӧ�ﵽ��ƽ��״̬����H2��CO2����ʼ���������ڻ�ѧ������֮�ȣ���Ӧ������n( H2)/n(CO2 )ʼ�ղ���������n( H2)/n(CO2 )���䲻��֤����ѧ��Ӧ�Ѵﵽƽ��״̬����D����ѡC��
��100%=7.7%����C��ȷ��D���ɷ���ʽ��֪����ѹǿ����ʱ��˵����Ӧ�ﵽ��ƽ��״̬����H2��CO2����ʼ���������ڻ�ѧ������֮�ȣ���Ӧ������n( H2)/n(CO2 )ʼ�ղ���������n( H2)/n(CO2 )���䲻��֤����ѧ��Ӧ�Ѵﵽƽ��״̬����D����ѡC��
(4).��Ӧǰ��������ƽ����Է�������=![]() =12.5�������������Ϊ(0��12.5)�����ŷ�Ӧ��������������ʵ�����С����������ƽ����Է���������������t0ʱ�ﵽ��ѧƽ������ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=
=12.5�������������Ϊ(0��12.5)�����ŷ�Ӧ��������������ʵ�����С����������ƽ����Է���������������t0ʱ�ﵽ��ѧƽ������ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=![]() =20����t0��ƽ��ʱ
=20����t0��ƽ��ʱ![]() Ӧ������12.5��20֮��������ͼ��Ϊ
Ӧ������12.5��20֮��������ͼ��Ϊ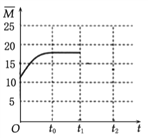 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
II. (5).�������ϣ�CO2�õ��ӷ�����ԭ��Ӧ���ʵ缫����ʽΪ3CO2+4Na++4e-=2Na2CO3+C���ʴ�Ϊ��3CO2+4Na++4e-=2Na2CO3+C��
(6).�����������ĵ缫��Ӧ��3CO2+4Na++4espan>-=2Na2CO3+C
3 4 2 1
0.15 0.2 0.1 0.05
m(��)=m(Na2CO3)+m(C)=106g/mol��0.1mol+12g/mol��0.05mol=11.2g���ʴ�Ϊ��11.2��
(7).ѡ���{�������ĸʴ������������Һ���ŵ��ǵ����Ժã�������Ʋ���Ӧ���ѻӷ��ȣ��ʴ�Ϊ�������Ժá�������Ʋ���Ӧ���ѻӷ����е���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����±仯��ֻ�ǹ��ۼ����ƻ�����
A.������������ˮB.���������Ȼ�̼
C.������������ȡ����ӦD.�Ȼ�����ȷֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E����Ԫ�ص�ԭ������������������Aԭ����������������������������ԭ��������ȣ�Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��s�����������p�����������������Dԭ��L���Ӳ�����2�ԳɶԵ��ӣ�E+ԭ�Ӻ�����3������Ҹ��������ȫ��״̬������д���пհף�
��1��EԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ ��
��2��B��C��D����Ԫ�صĵ�һ��������ֵ��С�����˳��Ϊ����Ԫ�ط��ţ�����ԭ��Ϊ ��
��3��B2A4����Ҫ�Ļ���ʯ�ͻ���ԭ�ϣ�B2A4������Bԭ�ӹ�����ӻ�����Ϊ��1mol B2A4�����к�mol�Ҽ���
��4����֪D��E���γɾ�����ͼ��ʾ�����ֻ����� 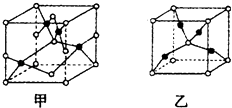 ��������Ļ�ѧʽ����Ϊ �� ��Ϊ������ʱ������ת��Ϊ�ҵ�ԭ��Ϊ ��
��������Ļ�ѧʽ����Ϊ �� ��Ϊ������ʱ������ת��Ϊ�ҵ�ԭ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ����������ռ���Һ��װ����ͼ��ʾ������������������Ϊ���Ե缫�����ͬ��ͬѹ�£�������������ҵ������ԼΪl��2�������й�˵����ȷ���ǣ� ��
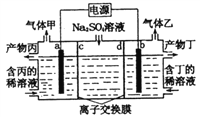
A. a�缫��ӦʽΪ��2H++2e-= H2��
B. �����Ϊ������Һ
C. ���ӽ���Ĥd Ϊ�����ӽ���Ĥ
D. ÿת��0.1mol���ӣ�����1.12 L��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������Ʊ���˵��������ǣ� ��
A.�ҹ��Ŵ����Ѳ��ü��ȵ������̷��ķ�����ȡ����
B.����Ȼ�þ��Һ���Եõ�����þ
C.�ƿ����ڴ��ѵ��Ȼ������û���������
D.��ҵ����������ʯ����Ϊԭ������Ư��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ܺ͵��ܵ��ת����������ת������Ҫ��ʽ֮һ����ͼ����ʵ��װ����ʵ�ֻ�ѧ�ܺ͵����ת����װ�ã�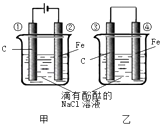
��1���ѻ�ѧ��ת��Ϊ���ܵ�װ��������ס����ҡ���
��2���ܵ缫�ϵĵ缫��ӦʽΪ
��3���ٵ缫�ϵĵ缫��Ӧʽ �� ����õ缫��Ӧ����ķ�����
��4���ס�����װ�õ缫��������Һ���ȱ��ĵ缫�ֱ�����������ţ�
��5��д��װ�üķ�Ӧ�ܷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ����
A. 2.4gþ�������Ŀ�������ȫȼ��ʱ����O2���ӵ���ĿΪ0.1NA
B. 1 molFe���ڹ������ᣬ����ת����Ϊ3NA
C. 14 g��ϩ�ͱ�ϩ������庬��̼̼˫����ĿΪ2NA
D. 5.6L������̼�����к��е���ԭ����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����������䵥λƥ����ȷ���ǣ� ��
A.��������g
B.��Ӧ���ʩ���molL��1
C.Ħ����������gmol��1
D.����Ħ���������Lmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ���500�����ҵ���м��ͨ��Cl2������ˮ�Ȼ��������Ʊ������о�Ҫȷ����ˮ����ģ��ù�����ͼʾװ�ý���ʵ�飺

��1������a������Ϊ________��װ��A��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ________��Ϊ����װ��CΪ��ˮ������װ��B�м�����Լ���________��
��2��ʵ�鲽�裺��ͼ����װ�ú���________����ʵ�����������װҩƷ��Ȼ���ȼ________������A������C�������ƾ��ƣ���________����ʵ������ʱ���ٵ�ȼ________������A������C�������ƾ��ơ�
��3��װ��D��������________��________��
��4����ͬѧ��Ϊ����װ��C�������л���HCl��Ӧ��װ��Bǰ����װ��________�����Լ����ƣ���ϴ��װ�ó�ȥ����ͬѧ��Ϊ����Ҫ��ȥHCl������Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com